広報活動
難病「肺高血圧症」の病態を解明―ヘルパーT細胞におけるIL-6シグナルが病態形成に関与する―
2024年4月16日
国立循環器病研究センター
国立循環器病研究センター(大阪府吹田市、理事長:大津欣也、略称:国循)研究所血管生理学部/病院心臓血管内科の中岡良和部長/副院長、稲垣薫克上級研究員、石橋知彦上級研究員、岡澤慎室長らの研究グループが、肺高血圧症の病態形成において、免疫に関わるT細胞の一種であるヘルパーT細胞におけるインターロイキン-6(Interleukin-6: IL-6)シグナルが重要な役割を果たしていることを明らかにしました。本研究の成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)に2024年4月11日(米国時間EST)にオンライン掲載されました。
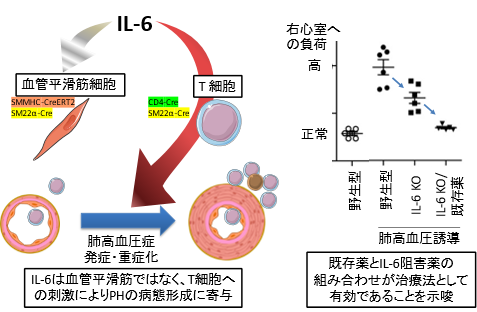
図1.本研究成果の概要
■背景
肺高血圧症(Pulmonary Hypertension: PH) は、心臓から肺へ血液を送る血管である肺動脈に狭窄や閉塞が生じて肺動脈圧が上昇する疾患で、治療が奏功しないと進行性で心不全に至ることもある、予後不良の厚生労働省の指定難病です(図2)。
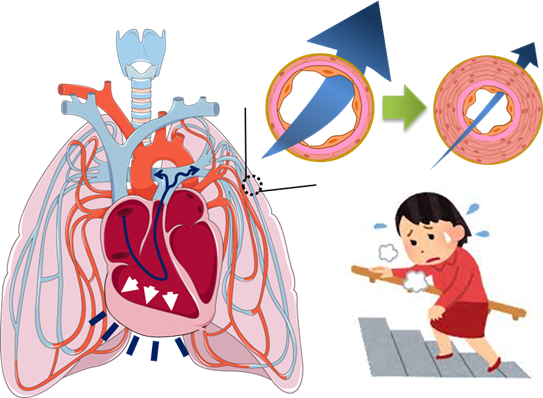
図2. 肺高血圧症(Pulmonary hypertension: PH)
PHは、心臓から肺に血液を送る血管である肺動脈の血液の流れが悪くなることで、肺動脈の血圧が高くなる病気の総称です。 肺動脈の血圧が高くなると、心臓に負担がかかり、息切れやだるさ、足のむくみ、失神、喀血といった症状が出るようになります。進行すると右心不全を併発して命を落とす重篤な疾患です。
PH発症には遺伝的素因に加えて、炎症や感染、薬物・化学物質曝露などが重要だと考えられて来ました。炎症の誘導において重要な役割を担う炎症性サイトカインのIL-6に焦点を当てて、低酸素負荷誘発性肺高血圧症(Hypoxia-induced Pulmonary Hypertension; HPH)マウスに対して、IL-6の作用を阻害する抗IL-6受容体抗体を投与するとHPH病態が抑制されることを我々は以前に報告しました(Hashimoto-Kataoka et al. Proc Natl Acad Sci U S A. 112: E2677-86, 2015) 。この報告で、我々はIL-6の作用によりCD4陽性ヘルパーT細胞、特にIL-17とIL-21を分泌するTh17細胞が肺に集積してHPH病態に関わることを示しました。その後、IL-6の主要な作用点として肺動脈平滑筋細胞が重要であるとする報告も他のグループからなされました(Tamura et al. J Clin Invest. 128:1956–70, 2018)。そこで今回、 (1)PH病態形成に重要なIL-6シグナルの受容細胞を明らかにすること、(2)重症PHラットモデルでのIL-6シグナル阻害が病態抑制に有効かについて検討することに取り組みました。
■研究手法と成果
どの組織/細胞でのIL-6シグナルを受け取ることがPHの病態形成に関与するかを明らかにするため、Cre-loxPシステム*1を用いて肺動脈を構成する血管内皮細胞や血管平滑筋細胞でIL-6受容体を構成する受容体コンポーネントの1つであるgp130*2を欠損させたマウスを作製して、HPH病態を検討しました。その結果、gp130を血管内皮細胞で欠損するマウスでは有意な変化はみられませんでしたが、平滑筋細胞特異的に遺伝子組み換えを誘導することが知られるCreマウスのSMMHC-CreERT2とSM22α-Creを用いてgp130を欠損させたマウスでは相反する結果となり、SM22α-Creを用いてgp130を欠損させたマウスでのみHPH病態が有意に抑制されました(図3)。
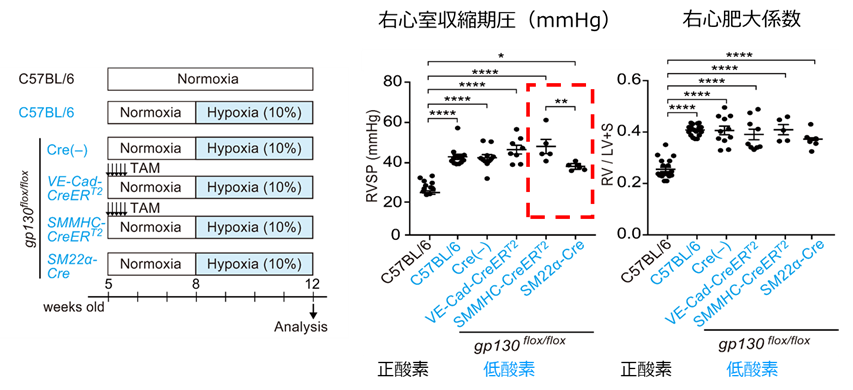
図3.血管平滑筋特異的にgp130が欠損する2種のマウスでは、低酸素による肺高血圧症病態に異なる表現型がみられ、SMMHC-CreERT2マウスでは改善がみられなかったのに対して、SM22α-Creマウスでは、右室収縮期圧、右室肥大の抑制傾向が認められた。
そこで、SM22α-Creが遺伝子組み換えを誘導する細胞系列を明らかにするため、レポーターマウス*3を作製して解析すると、血管平滑筋だけでなく、造血幹細胞を含む血球細胞でもCre依存性の遺伝子組み換えが生じていることが明らかになりました。また、既存のデータベースから、gp130はT細胞に多く発現することが分かりました。そこで、CD4陽性T細胞(ヘルパーT細胞)でgp130を欠損するマウスを作製して、HPH病態を検討するとPH病態は有意に抑制されました(図4)。
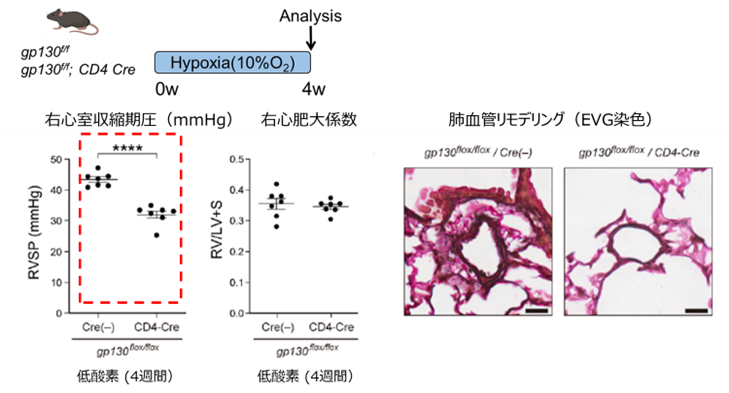
図4.CD4陽性細胞特異的にgp130が欠損するマウスでは、低酸素による肺高血圧症病態が有意に改善する
以上より、HPH病態形成においてヘルパーT細胞でのIL-6シグナルが重要であることが明らかとなりました(図1)。また、平滑筋細胞特異的な遺伝子欠損を誘導する際に汎用されてきたSM22α-Creマウスは、平滑筋細胞のみならず血球細胞でも遺伝子欠損を誘導してしまうことが明らかとなり、実験結果の解釈において慎重に対応する必要があると考えられます。
HPHマウスの病態は軽症から中等症のレベルであることが知られています。そこで、重症PHモデルにおけるIL-6シグナル阻害がPH病態の抑制に有効であるかを明らかにするため、CRISPR-Cas9*4の系を用いてIL-6欠損ラットを作製しました。重症PHのモデルでは肺動脈周囲にマクロファージやヘルパーT細胞が集簇して、ヘルパーT細胞の一部ではIL-6シグナルの下流で活性化するSTAT3のリン酸化が生じていることも認められました。一方、IL-6欠損ラットでは肺血管のリモデリング*5が抑制されて、肺血管周囲の免疫細胞の集簇も顕著に減少していました。更に、現在臨床で使用されるPH治療薬(肺血管拡張薬)とIL-6阻害の併用効果を検討したところ、代表的なPH治療薬を単独で投与した場合より、IL-6欠損ラットへ投与した場合に有意なPH病態抑制の効果が観察されました。以上より、重症PHの治療では既存の肺血管拡張薬とIL-6阻害が相加的に作用する可能性が示唆されました(図1)。
■今後の展望と課題
本研究では、PHの発症や進展にヘルパーT細胞におけるIL-6シグナルが関与していることを明らかしました。今後の課題として、IL-6がいつどこで産生されるのか、また、IL-6シグナルを受容したヘルパーT細胞がどのようにPH病態形成に関与するか?のメカニズムを明らかにすることが必要と考えられます。現在、我々はIL-6の下流因子としてヘルパーT細胞から産生されるIL-21に着目して、IL-21阻害によるPHの新規治療法開発を国立研究開発法人日本医療研究開発機構(AMED)の支援のもとで研究を進めています。
我々と京都大学医学研究科医化学講座・竹内理教授らとの共同研究で、炎症のブレーキとして機能するRNA結合タンパク質であるRegnase-1はIL-6、PDGFをはじめとする複数のサイトカインのmRNAを分解することで肺高血圧症の発症予防に関与することを2022年に報告しました(Yaku et al. Circulation. 146:1006-1022, 2022)。Regnase-1を肺胞マクロファージなどで欠損するマウスは重症PHを自然発症することから、複数のサイトカインを介したシグナルがPHの重症化には関与することも予想されます。今回の研究結果と合わせると、複数のサイトカインの作用を効率良く同時に抑制するような治療法が、PHの新しい治療法として有望な可能性も示唆されます。今後、さらに研究を進めて、新しいPHの有効な治療法を開発したいと考えています。
■発表論文情報
著者:Tomohiko Ishibashi*, Tadakatsu Inagaki*, Makoto Okazawa, Akiko Yamagishi, Keiko Ohta-Ogo, Ryotaro Asano, Takeshi Masaki, Yui Kotani, Xin Ding, Tomomi Chikaishi-Kirino, Noriko Maedera, Manabu Shirai, Kinta Hatakeyama, Yoshiaki Kubota (慶應義塾大学医学部解剖学教室), Tadamitsu Kishimoto#(大阪大学免疫学フロンティア研究センター), Yoshikazu Nakaoka# (*co-first author, #co-correspondence)
題名:IL-6/gp130 signaling in CD4+ T cells drives the pathogenesis of pulmonary hypertension
掲載誌:Proceedings of the National Academy of Sciences of the United States of America
■謝辞
本研究は、下記機関より資金的支援を受け実施されました。
・科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ(JPMJPR13M5)
・文部科学省科学研究費 (16H05298, 19K17622, 19K08506, 21K08070, 22K08144, 22H04379, 23K07568)
・国立研究開発法人国立循環器病研究センター循環器病研究若手開発費(29-6-5, 30-6-4, 30-2-3)
・公益財団法人先進医薬研究振興財団、公益財団法人武田科学振興財団、公益財団法人細胞科学研究財団、公益財団法人上原記念生命科学財団、公益財団法人第一三共生命科学研究振興財団、公益財団法人喫煙科学研究財団、GSKジャパン研究助成、⽇本新薬株式会社公募研究助成、岸本基金、ヤンセンファーマ株式会社受託研究、中外製薬株式会社受託研究
<注釈>
(注1)Cre-loxPシステム
1981年にバクテリオファージP1の研究で見出された部位特異的組換え反応を用いた技術で、loxP配列と呼ばれるDNA配列に対してDNA組換え酵素Creが働くことにより生じる部位特異的組換え反応を利用した遺伝子組換え実験系である。
(注2)gp130
gp130は、IL-6ファミリーサイトカインの共通の受容体コンポーネントであり、インターロイキン6シグナルトランスデューサー(IL6ST)とも呼ばれる。IL-6受容体αと複合体を形成してIL-6シグナルを細胞内に伝達する。
(注3)レポーターマウス
ある遺伝子の発現を可視化するために発現を可視化したい遺伝子の発現制御領域下に蛍光タンパク質をコードしたDNAを挿入することにより,その遺伝子の発現と同調して、蛍光タンパク質により細胞が蛍光を発するように遺伝子を改変したマウス。
(注4)CRISPR-Cas9
意図した場所のゲノムDNAを切断して、細胞のゲノム編集を行うことが可能な技術。
(注5)血管リモデリング
血管に対する血圧や血流などの血行動態の変化や種々の因子に対して血管が構造を変化されることと定義されている。肺高血圧症における血管リモデリングには血管の周皮細胞の筋性化や血管中膜肥厚、内膜増殖および叢状病変がある。
【報道機関からの問い合わせ先】
国立循環器病研究センター企画経営部広報企画室
TEL : 06-6170-1069(31120)
MAIL: kouhou@ml.ncvc.go.jp
最終更新日:2024年04月16日
