広報活動
血管狭窄時の新生内膜形成に内皮間葉転換が寄与する 〜血管リモデリングの仕組みを解明〜
2022年12月22日
国立大学法人筑波大学
国立研究開発法人国立循環器病研究センター
血管の内表面(上皮)を構成する血管内皮細胞が非上皮系の間葉細胞へと分化転換するプロセス(内皮間葉転換:EndMT)は、さまざまな血管リモデリングに関与することが知られています。しかし、血管狭窄の原因となる新生内膜形成(血管の内側の層が厚くなる)における、EndMTの役割と分子制御機構はこれまで明らかにされていませんでした。本研究では、マウス頸動脈結紮(けっさつ)モデルを用いて、血流が停止した状態によって結紮部位よりも中枢側の頸動脈が狭窄するプロセスを経時観察しました。これまで考えられていた中膜が主体の閉塞ではなく、最も内層の血管内皮細胞が新生内膜形成に寄与することを見いだしました。さらに、血管内皮細胞の形質を維持したままEndMTが生じる現象「部分的な内皮間葉転換: partial EndMT」が狭窄に関わることを明らかにしました。
この分子メカニズムを明らかにするためにヒト動脈内皮細胞を用いて、血流停止を模倣した低酸素環境が、①血球細胞マーカーであるCD45発現を伴ってEndMTを誘導すること ②細胞-細胞間の接着を維持する仕組みが、partial EndMTの制御に重要であることを突き止めました。
本研究により、血管狭窄の原因となる新生内膜の由来が血管内皮細胞であること、さらに内皮細胞のEndMTが血管狭窄時の血管リモデリングに寄与することが明らかになりました。今後、partial EndMTの詳細なメカニズムを解明することにより、EndMTを標的とした、血管狭窄の新たな治療法開発につながると期待されます。
研究代表者
筑波大学生存ダイナミクス研究センター
山城 義人 准教授(現:国立循環器病研究センター 先端医療技術開発部 室長)
柳沢 裕美 教授


研究の背景
血管の内腔面を構成する血管内皮細胞が非上皮系の間葉細胞へと分化転換するプロセスである内皮間葉転換(EndMT:Endothelial-to-Mesenchymal Transition)は、血管リモデリング注1)において重要な役割を担っており、近年、血管疾患発症の原因として提唱されています。一般的なEndMTは、サイトカインTGF-β(transforming growth factor-beta)の働きが活性化することで生じる不可逆的な変化だと解釈されていますが、可逆的な状態としての部分的内皮間葉転換(partial EndMT)が治療介入点になりうる状態として注目され始めています。しかし、partial EndMTの分子メカニズムについては不明な点が多く、血管病態への関与も分かっていません。また、血管狭窄の原因となる新生内膜注2)肥厚機構や、新生内膜形成時の血管リモデリング機構の詳細については、さまざまな報告がされており、統一された見解がないのが現状です。
研究内容と成果
本研究グループはまず、8週齢のマウスに頸動脈結紮を施行し、血流を停止させ、結紮部より中枢側の狭窄進展部位の新生内膜形成による血管狭窄のプロセスを経時観察しました。狭窄初期の術後1週間では、血管内皮細胞に、間葉系細胞のマーカータンパク質であるα-SMAと血管内皮細胞のマーカーである細胞接着分子PECAMが共発現するとともに、血球細胞マーカーであるCD45が発現していました。狭窄が起き始める術後2〜3週になると、新生内膜細胞に、α-SMAとPECAMの両方が発現しました。また、結紮した頸動脈では、TGF-βの働きが活性化していることから、EndMTが新生内膜の形成に寄与している可能性が示されました。次に、新生内膜細胞の起源と血管内皮細胞との関連性を精査するために、血管内皮細胞系譜解析システム(VE-Cadherin (Cdh5)-BAC-CreERT2-LSL-EGFPマウス)を用いて頸動脈結紮を行い、蛍光標識された血管内皮細胞が狭窄のプロセスでどこに局在するのかを解析しました。その結果、新生内膜細胞がEGFPで標識されることから、血管内皮細胞が新生内膜に寄与しており、血管狭窄の原因であることが強く示唆されました。
さらに、生体での血流停止、すなわち内皮細胞への低酸素状況による影響を調べるために、ヒト動脈内皮細胞を用いて低酸素状態を誘導すると、CD45発現を伴うEndMTが引き起こされることが分かりました。加えて、CD45の脱リン酸化酵素活性依存的に、細胞膜上の細胞接着分子integrinα11の発現誘導と、integrin b1 内因性阻害タンパク質であるSHARPINとの複合体形成が促進されることで、血管内皮細胞同士の接着が維持され、partial EndMTの保持に重要な役割を担っていることを明らかにしました。血管内皮細胞特異的なHif1α欠損マウスでは、新生内膜形成が抑制されることから、血管狭窄の発症に低酸素応答シグナルが関与していると考えられます。
今後の展開
本研究は、血管狭窄の原因となる新生内膜の形成に関わる細胞が、血管内皮細胞由来であることを明らかにし、EndMTが血管狭窄時の血管リモデリングに寄与することを示しました(参考図)。今後、血管内皮細胞形質を維持したままのpartial EndMTの詳細なメカニズムの解明により、EndMTを標的とした血管狭窄の新たな治療法開発につながると期待されます。
参考図
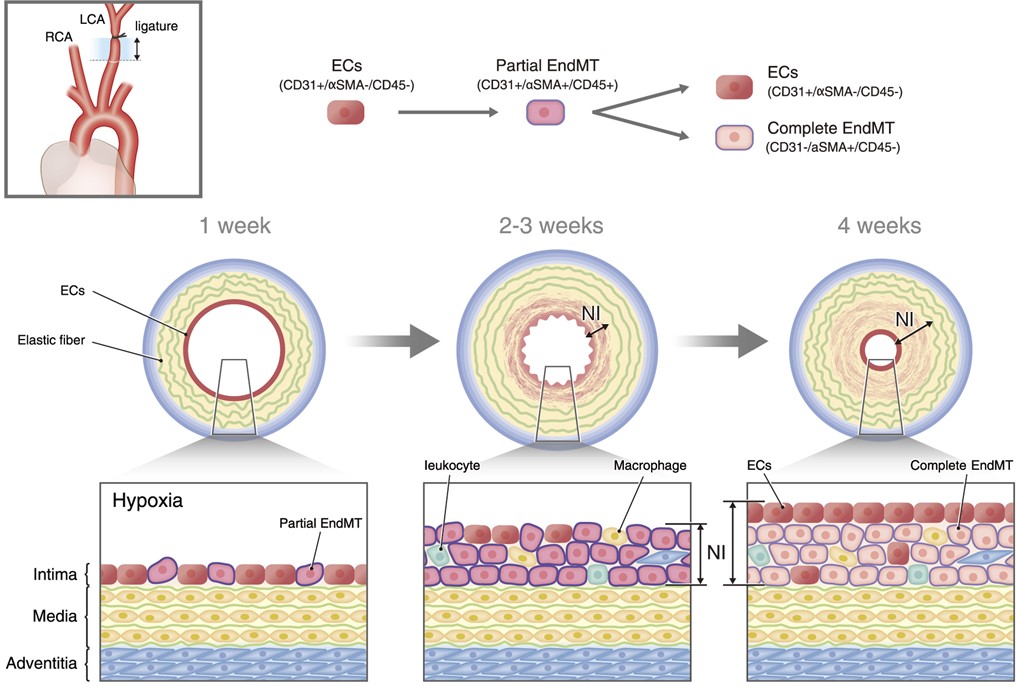
図 頸動脈結紮時における血管狭窄の原因となる新生内膜形成の概略
左上枠内:左総頸動脈(LCA)を糸で完全結紮(ligation)することにより血流を停止させる頸動脈結狭窄モデル。右総頸動脈(RCA)は結紮しないため、比較対象として使用する。術後、中枢(心臓)側の部位(両矢印部分:水色)を採取して解析に用いる。
上図:血管内皮細胞(ECs)、Partial EndMTとComplete EndMTで発現している分子マーカー
下図:頸動脈結紮後の狭窄の進行度合いと血管内皮細胞の関与。術後1週間でIntima(内膜)内の血管内皮細胞において、部分的な内皮間葉転換(partial EndMT : CD31+/αSMA+/CD45+)が観察され、2-3週間で新生内膜(NI)の細胞が増殖し、4週間程度でComplete EndMThへと進行し、新生内膜が形成される。Elastic fiber(弾性線維)、Hypoxia(低酸素)、Media(中膜)、Adventitia(外膜)、 Macrophage(マクロファージ)。
用語解説
注1)血管リモデリング
種々の刺激に対する、血管を構成する細胞(内皮細胞、平滑筋細胞、線維芽細胞)や細胞外マトリクスの変化を伴った、血管の構造及び機能変化。
注2)新生内膜
血管障害後に形成される血管壁を構成する細胞層。
研究資金
本研究は、日本医療研究開発機構(AMED)循環器疾患・糖尿病等生活習慣病対策実用化研究事業「細胞外マトリクスを介した血管リモデリング機構の解明と加齢変化の解析」、科研費・基盤研究(B)、日本応用酵素協会、武田科学振興財団、MSD生命科学財団、先進医薬研究振興財団、かなえ医薬振興財団、ノバルティス科学振興財団、三菱自然科学財団、難病医学研究財団、他の研究プロジェクトの一環として実施されました。
掲載論文
【題 名】 Partial endothelial-to-mesenchymal transition (EndMT) mediated by HIF-induced CD45 in neointima formation upon carotid artery ligation.
(頸動脈結紮後の新生内膜は、低酸素誘導性のCD45発現による部分的な内皮間葉転換により形成される)
【著者名】 Yoshito Yamashiro, Karina Ramirez, Kazuaki Nagayama, Naoko Hattori, Yu-Yu Liu, Shinji Matsunaga, Shuhei Tomita, Yoshiaki Kubota and Hiromi Yanagisawa
【掲載誌】 Cardiovascular Research
【掲載日】 2022年12月20日(オンライン先行公開)
【DOI】 10.1093/cvr/cvac190
問合わせ先
【研究に関すること】
山城 義人(やましろ よしと)
国立循環器病研究センター 先端医療技術開発部 室長
TEL: 06-6170-1070
E-mail: yamayoshito@ncvc.go.jp
URL: https://chura-rhythm.com
柳沢 裕美(やなぎさわ ひろみ)
筑波大学 生存ダイナミクス研究センター 教授
TEL: 029-853-7318
E-mail: hkyanagisawa@tara.ac.jp
URL: https://www.saggymousehkytsukuba.com
【取材・報道に関すること】
筑波大学広報局
TEL: 029-853-2040
E-mail: kohositu@un.tsukuba.ac.jp
国立研究開発法人国立循環器病研究センター
企画経営部広報企画室
TEL: 06-6170-1069(31120)
E-mail: kouhou@ml.ncvc.go.jp
個別取材の手続きは、こちらからご確認いただけます。
最終更新日:2023年01月16日
