循環動態制御部
研究内容
循環器系の神経性・体液性調節の研究
循環器系の神経性・体液性調節の研究
生体には、種々の神経性および体液性の循環調節機構が備わっています。これらの循環調節機構は、循環器疾患の成因として重要な役割を果たしています。多くの循環調節系は、過渡応答をもつ動的な負帰還系であり、非線形性を示し、また多入力系であるという特徴があります。私たちはこのような系の性質を偏りなく、効率よく解析することのできるガウス白色雑音法を用いることにより、循環調節機構の性質を詳細に求めることに成功し、循環調節について制御工学の立場から検討を加えました。このようにして求めた循環調節系の性質は、バイオニック医学の基礎データとなり、また病態における循環調節系異常の解明に重要です。
(1) 圧反射系の系統解析:中枢弓と末梢弓の動特性の意義
動脈圧を一定に制御する圧反射系は、循環調節系で最も重要な調節系のひとつです。動脈圧反射系には過渡応答特性があり、その特性のいかんによって、生体に外乱が加わった際にいかに血圧を一定にできるかが変わってきます。血圧が下がろうとするときに、いかに迅速に(高速性)、いかに振動なしに(安定性)、もとの血圧近くまで戻せるかが重要であり、これらを両立し得るような制御系が求められます。
私たちはガウス白色雑音法を用い、圧反射系の中枢弓(圧受容器および圧反射中枢)と末梢弓(効果器)の性質を分けて解析しました。その結果、正常動物においては中枢弓が末梢弓の応答の遅さを代償することで、速度及び安定性の面で血圧調節を最適化していることが分かりました。このような特性を数学的モデルで表し、過渡応答をシミュレーションすることで、病態における血圧調節異常の解明を進めています。慢性心不全ラットや糖尿病ラットでは過渡応答特性が変化し、姿勢変化などで起こる急速な外乱に対する血圧調節機能が低下していることが分かりました。したがって、たとえ安静時に正常血圧が保たれていたとしても、心不全や糖尿病ではわずかなきっかけで血行動態が悪化してしまうことが予測され、より健康管理に気を配ることが大切と言えます。
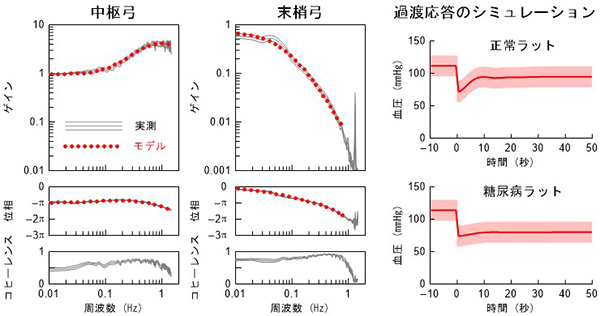
図1 圧反射中枢弓と末梢弓の動特性および血圧応答のシミュレーション
関連成果等
- Kawada T, Sugimachi M. Open-loop static and dynamic characteristics of the arterial baroreflex system in rabbits and rats. J Physiol Sci. 66: 15-41, 2016 (review).
- Kawada T, Shimizu S, Hayama Y, Yamamoto H, Saku K, Shishido T, Sugimachi M. Derangement of open-loop static and dynamic characteristics of the carotid sinus baroreflex in streptozotocin-induced type 1 diabetic rats. Am J Physiol Regul Integr Comp Physiol. 315: R533-R567, 2018.
(2) 圧反射系の統合モデル
圧反射中枢弓は感知した血圧の速い変化を強調する高域通過特性(動特性)をもつことは上で述べたとおりですが、一方、動作する血圧値の高低によっても反応のしかたが変わります。定常的な応答(静特性)は通常の血圧付近で最も大きく、高血圧、低血圧のいずれでも応答が小さくなるS字状の応答を示します。これらの動特性と静特性を同時に表現できる統合モデルを作成し、交感神経を介した血圧調節の理解を進めています。このようなモデルを使うことで、たとえば平均圧、脈圧が全く同じ血圧波形であっても、波形の違い(たとえば、前向き鋸歯状波と後ろ向鋸歯状波)によって圧反射を活性化する程度が変わることをうまく説明することができました。
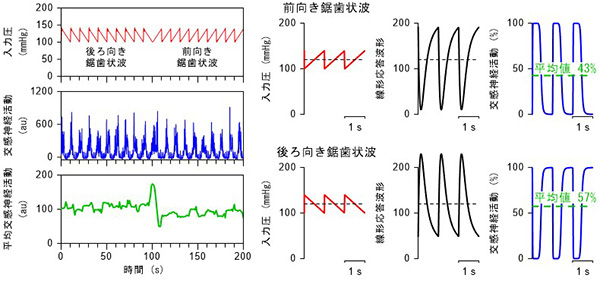
図2 入力圧波形の違いが交感神経活動に及ぼす影響の統合モデルによる説明
関連成果等
- Moslehpour M, Kawada T, Sunagawa K, Sugimachi M, Mukkamala R. Nonlinear identification of the total baroreflex arc: chronic hypertension model. Am J Physiol Regul Integr Comp Physiol. 310: R819-827, 2016.
- Moslehpour M, Kawada T, Sunagawa K, Sugimachi M, Mukkamala R. Nonlinear identification of the total baroreflex arc: higher-order nonlinearity. Am J Physiol Regul Integr Comp Physiol. 311: R994-1003, 2016.
- Kawada T, Shimizu S, Yamamoto H, Miyamoto T, Kamiya A, Shishido T, Sugimachi M. Effects of different input pressure waveforms on the carotid sinus baroreflex-mediated sympathetic arterial pressure response in rats. J Appl Physiol. 123: 914-921, 2017.
(3) 平衡線図解析による圧反射系の動作点決定要因の検討
圧反射系によって動脈圧はほぼ一定に調節されていますが、どのレベルの血圧値(動作点)に調節されるのかは、自明ではありません。圧反射において、中枢弓は血圧が高いほど交感神経活動が小さくなる関係、末梢弓は交感神経活動が大きいほど血圧が高くなる関係を示すので、中枢弓と末梢弓の特性を、縦軸を圧、横軸を交感神経活動としてプロットすると、両者が1つの点、すなわち、動作点で交わります。これが圧反射の平衡線図解析と呼ばれるものです。私たちは循環系に作用する様々な薬剤が、圧反射の平衡線図に及ぼす影響を系統的に調べてきました。たとえば、選択徐脈薬であるイバブラジンは、急性効果としては圧反射平衡線図をほとんど変化させませんでした。心不全治療に用いられる代表的なβ遮断薬であるメトプロロールとカルベジロールを比較すると、末梢弓に対する作用に大きな違いがあることが分かりました。また、これまで中枢性の交感神経抑制薬に分類されていた薬剤が、末梢においては血管を収縮させ、降圧作用を制限していることを明らかにしました。末梢性の血管収縮作用の少ない中枢性の交感神経抑制薬を使えば、中枢性の交感神経抑制を標的とした循環器疾患の治療が進むと考えられます。
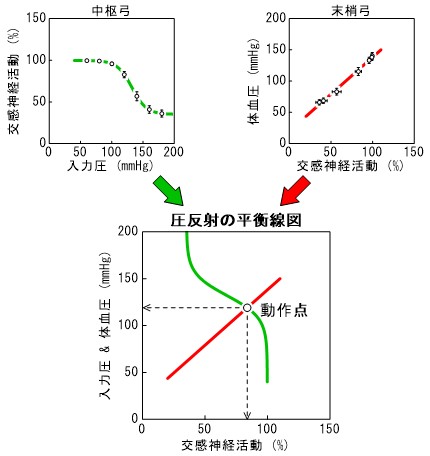
図3 動脈圧反射の平衡線図解析
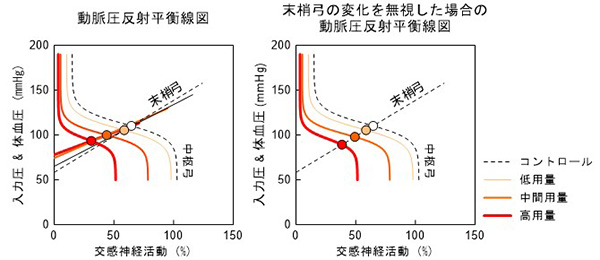
図4 リルメニジンが動脈圧反射に及ぼす影響の平衡線図解析
関連成果等
- Yamamoto H, Kawada T, Shimizu S, Uemura K, Inagaki M, Kakehi K, Iwanaga Y, Fukuda K, Miyamoto T, Miyazaki S, Sugimachi M. Ivabradine does not acutely affect open-loop baroreflex static characteristics and spares sympathetic heart rate control in rats. Int J Cardiol. 257: 255-261, 2018.
- Yamamoto H, Kawada T, Shimizu S, Hayama Y, Shishido T, Iwanaga Y, Fukuda K, Miyazaki S, Sugimachi M. Acute effects of intravenous carvedilol versus metoprolol on baroreflex-mediated sympathetic circulatory regulation in rats. Int J Cardiol 285: 65-71, 2019.
- Kawada T, Hayama Y, Nishikawa T, Yamamoto H, Tanaka K, Sugimachi M. Even weak vasoconstriction from rilmenidine can be unmasked in vivo by opening the baroreflex feedback loop. Life Sci. 219: 144-151, 2019.
(4) 迷走・交感神経による心拍数調節の二重支配の意義
心拍数は交感神経と迷走神経による調節を受けていますが、その二重支配の意義については明らかではありません。そこで、私たちはこれらの神経による心拍数調節の相互作用をガウス白色雑音法によって検討しました。その結果、交感神経と迷走神経は定常的な心拍数の調節に関しては、拮抗的に働くにもかかわらず、動的な心拍数の調節には協調的に働くことが明らかになりました。この協調的な相互作用は生理的条件下での心拍数調節の動作範囲を広くするのに役立っていると考えられました。一方で、迷走神経終末からのアセチルコリンの放出が交感神経活動によって抑制されるという接合部前抑制という作用が知られています。この接合部前抑制作用と協調作用の程度を調べたところ、協調作用がみられる条件では、接合部前抑制はあまり強く作用しないことが分かりました。また、これら神経性の心拍数調節に対して、心臓の洞結節に作用する選択的徐脈薬イバブラジンがどのような影響を与えるかを検討しました。その結果、イバブラジンの静脈投与は徐脈を起こすにも関わらず、β遮断薬とは異なり、交感神経性の心拍数調節の動特性を維持することが分かりました。また、イバブラジンの静脈投与は迷走神経性の心拍数調節の動特性を増強する作用があることが分かりました。
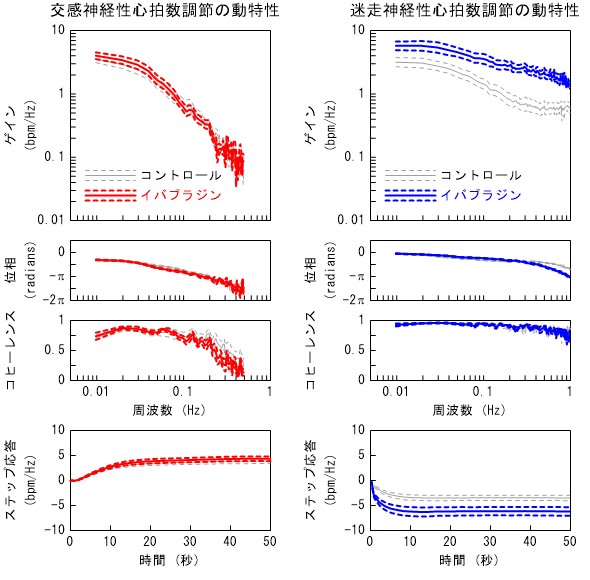
図5 イバブラジンが自律神経による心拍数調節の動特性に及ぼす影響
関連成果等
- Kawada T, Sonobe T, Hayama Y, Nishikawa T, Miyamoto T, Akiyama T, Pearson JT, Sugimachi M. Accentuated antagonism of vagal heart rate control and less potent prejunctional inhibition of vagal acetylcholine release during sympathetic nerve stimulation in the rat. Auton Neurosci 218: 25-30, 2019.
- Kawada T, Shimizu S, Uemura K, Hayama Y, Yamamoto H, Shishido T, Nishikawa T, Sugimachi M. Ivabradine preserves dynamic sympathetic control of heart rate despite inducing significant bradycardia in rats. J Physiol Sci 69: 211-222, 2019.
- Kawada T, Yamamoto H, Uemura K, Hayama Y, Nishikawa T, Sugimachi M. Intravenous ivabradine augments the dynamic heart rate response to moderate vagal nerve stimulation in anesthetized rats. Am J Physiol Heart Circ Physiol 317: H597-H606, 2019
最終更新日:2021年10月01日
