循環動態制御部
研究内容
循環バイオニック医学の研究
循環バイオニック医学の研究
循環動態制御部では、生体、特に自律神経系との間で種々の情報を交換しながら、治療を行う医療機器の開発を行っています。バイオニック医学とは、生体における神経系の情報を解読して治療のためにフィードバックさせる方法や、生体の神経系を至適に刺激することで目的の治療効果を得る方法の研究開発を指しています。脳や神経系と情報を交換できれば、色々なバイオニック治療機器が実現できると考えられます。本研究では、迷走神経や圧反射神経に対して介入することで慢性重症心不全や薬剤抵抗性の高血圧を治療する研究を進めています。
(1) 慢性心不全のバイオニック治療
重症の心筋梗塞では、心機能が低下して慢性期に持続的に交感神経の活動が増強します。これは心臓リモデリングを惹起して悪循環を形成し、予後を悪化させています。私たちは交感神経と拮抗する作用を持つ迷走神経を電気刺激して活性化させると、心筋梗塞を起こしたラットの心臓リモデリングや心筋の細胞死が抑制され、生存率が飛躍的に向上することを明らかにしました。このような迷走神経刺激治療が、慢性心不全の標準的な治療薬のひとつであるβ遮断薬と併用可能かどうかを検討したところ、β遮断薬の単独治療に比べて迷走神経電気刺激との併用治療のほうが、心臓リモデリングをより強く抑制し、心拍出量の改善効果も大きいことが分かりました。この研究により、迷走神経刺激治療とβ遮断薬との併用による慢性心不全治療の可能性が示されました。
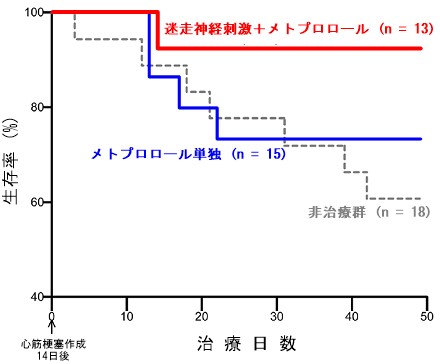
図1 迷走神経刺激とβ遮断薬の併用が心筋梗塞後ラット慢性心不全の生存率に及ぼす影響
関連成果等
- Li M, Zheng C, Kawada T, Inagaki M, Uemura K, Sugimachi M. Chronic vagal nerve stimulation exerts additional beneficial effects on the beta-blocker-treated failing heart. J Physiol Sci 69: 295-303, 2019.
(2) 慢性心不全の薬理学的バイオニック治療
心筋梗塞の縮小や心不全への移行・重症化の抑制には迷走神経の活動を増加させることが重要ですが、迷走神経の電気刺激は咳や痛みなどのために十分に刺激強度を上げられない場合があることが報告されています。そこで、電気刺激ではなく薬理学的な方法で迷走神経を活性化する研究を行っています。その結果、アセチルコリンエステラーゼ阻害薬であるドネペジルの経口投与によって、迷走神経の電気刺激と同様の効果が得られることが明らかになりました。さらに、このような迷走神経を標的とした薬理的バイオニック治療は、その作用機序の違いからアンジオテンシン受容体拮抗薬ロサルタンとの併用が可能であり、慢性心不全ラットの治療効果がドネペジルとロサルタンの併用治療によって向上することが明らかとなりました。また、薬理学的バイオニック治療が、高血圧を合併した重症心不全にも適用可能かどうかを検討するために、高血圧自然発症ラットにおいて心筋梗塞を起こし、ドネペジルにて治療したところ、心筋梗塞後の心臓リモデリングが抑制され、心機能や血中の神経性液性因子の改善がみられました。
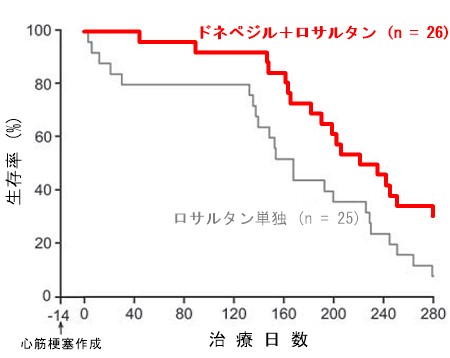
図2 ドネペジルによる迷走神経活性化とロサルタンの併用が心筋梗塞後ラット慢性心不全の生存率に及ぼす影響
関連成果等
- Li M, Zheng C, Kawada T, Inagaki M, Uemura K, Sugimachi M. Adding the acetylcholinesterase inhibitor, donepezil, to losartan treatment markedly improves long-term survival in rats with chronic heart failure. Eur J Heart Fail. 16: 1056-1065, 2014.
- Li M, Zheng C, Kawada T, Inagaki M, Uemura K, Shishido T, Sugimachi M. Oral donepezil markedly suppresses the progression of cardiovascular remodeling and improves the prognosis in spontaneously hypertensive rats with myocardial infarction. ESC Congress 2018.
- 特許出願:心筋梗塞縮小薬.
(3) 迷走神経活動賦活薬の系統的探索
前項で述べたドネペジルのようにアセチルコリンの分解を阻害して迷走神経を活性化する薬剤は重症心不全や心筋梗塞の治療薬として有用と考えられます。しかし、その他の作用で迷走神経を活性化する薬剤を探索する際、麻酔下の動物で迷走神経の電気活動を記録することは難しく、また心臓への遠心路の活動だけを分離して評価することも困難でした。そこで私たちは、心臓微小透析法を用いて心臓へのアセチルコリンの分泌を測定する研究を行っています。その結果、α2交感神経刺激薬(メデトミジンやグアンファシン)に迷走神経の活性化作用があることが明らかになりました。また、古典的な抗うつ薬であるデシプラミンも中枢性にα2受容体を刺激して迷走神経を活性化することを示しました。ただし、このような中枢を介した迷走神経の活性化は、主に正常動物を用いて確認されたものであり、たとえば1型糖尿病モデルラットでは、メデトミジンによる迷走神経の活性化が障害されていることが分かりました。これらのドネペジル以外の迷走神経の活性化薬が慢性心不全などの病態に適用可能かどうかは、今後の研究で明らかにしていく必要があります。
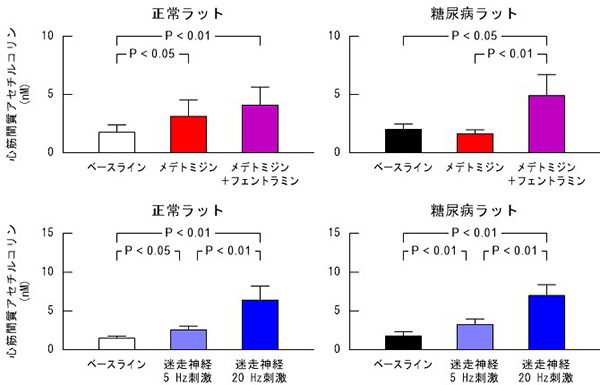
図3 糖尿病ラットにおけるメデトミジンによる中枢性迷走神経活性化機構の障害
関連成果等
- Shimizu S, Kawada T, Akiyama T, Turner MJ, Shishido T, Kamiya A, Shirai M, Sugimachi M. Guanfacine enhances cardiac acetylcholine release with little effect on norepinephrine release in anesthetized rabbits. Auton Neurosci. 187: 84-87, 2015.
- Kawada T, Akiyama T, Shimizu S, Fukumitsu M, Kamiya A, Sugimachi M. Desipramine increases cardiac parasympathetic activity via α2-adrenergic mechanism in rats. Auton Neurosci. 205: 21-25, 2017.
- Kawada T, Akiyama T, Sonobe T, Shimizu S, Hayama Y, Pearson JT, Shishido T, Sugimachi M. Central activation of cardiac vagal nerve by α2-adrenergic stimulation is impaired in streptozotocin-induced type 1 diabetic rats. Auton Neurosci. 216: 39-45, 2019.
(4) 圧反射活性化治療に関する研究
生体内には動脈の血圧を一定に保つための調節系があり、負帰還(ネガティブ・フィードバック)機構によってこれを実現しています(圧反射系)。このシステムは生体に加わった外乱による血圧の変動を少なくする作用があり、体位の変換などでも大きな血圧の変動がないように常時動作しています。このシステムを電気的に刺激することで、交感神経の抑制と迷走神経の活性化を起こし、高血圧や慢性心不全を治療しようとする圧反射活性化治療が報告されています。私たちはシステム解析の観点からこの圧反射活性化治療に関する研究を行っています。その結果、圧反射活性化治療において、交感神経活動及び血圧の持続的な抑制には、圧反射求心路の無髄線維が重要な役割を果たすことを明らかにしました。また、外部からの電気的な圧反射活性化が、生体側にもともと存在する圧反射機能に影響を与えないか検討したところ、圧反射神経の定常的な電気刺激は交感神経活動を抑制し、血圧を下げるものの、中枢性や末梢性の相互作用を介して、生体側の圧反射を介した血圧調節の動的な性質に大きな影響を与えることはないことが分かりました。
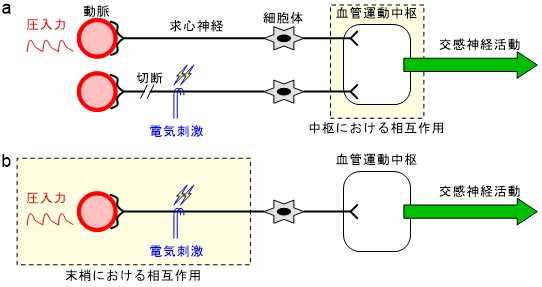
図4 外部からの圧反射求心路の電気刺激が生体側の圧反射に影響を与える可能性の概念図
関連成果等
- Kawada T, Turner MJ, Shimizu S, Fukumitsu M, Kamiya A, Sugimachi M. Aortic depressor nerve stimulation does not impede the dynamic characteristics of the carotid sinus baroreflex in normotensive or spontaneously hypertensive rats. Am J Physiol Regul Integr Comp Physiol. 312: R787-R796, 2017.
- Kawada T, Turner MJ, Shimizu S, Kamiya A, Shishido T, Sugimachi M. Tonic aortic depressor nerve stimulation does not impede baroreflex dynamic characteristics concomitantly mediated by the stimulated nerve. Am J Physiol Regul Integr Comp Physiol. 314: R459-R467, 2018.
- Kawada T, Mukkamala R, Sugimachi M. Linear and nonlinear analysis of the carotid sinus baroreflex dynamic characteristics. ABE 8: 110-123, 2019 (review).
最終更新日:2021年10月01日
