心臓生理機能部
研究内容
心不全に対する新規治療薬開発(共同研究)
3)心不全に対する新規治療薬開発(共同研究)
近年、高齢化に加えて高血圧・肥満・糖尿病などの様々なリスク因子が重なることにより病態が多様化・複雑化している心不全に対して、より効果的な新しい治療薬の開発を目指し、Cardurion Pharmaceuticalsおよび武田薬品工業との共同研究計画を締結した。
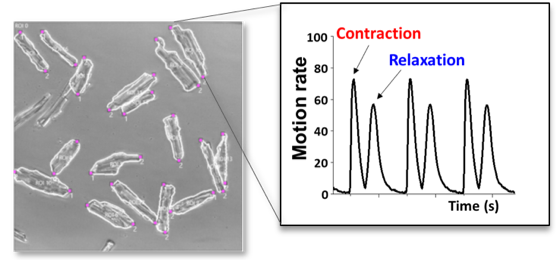
まず、大動脈狭窄術による心不全マウスを作成し、開発中の新規化合物を投与してその効果を調べた。その結果、新規化合物を投与したマウスでは、心不全の進行に伴う心肥大や心筋組織の線維化、および心房性ナトリウム利尿ペプチド ANPの発現が抑制されることがわかってきた。また、先進のライブセルイメージングシステムなどを用いて心筋細胞レベルでの収縮・弛緩能力を測定することにより、心筋細胞に対する新規化合物の効果を調べている。
今後、様々な心不全モデル、心筋症モデル動物を用いて、新規化合物による治療効果を検証していくと共に、心不全病態の増悪に寄与する酸化ストレスやミトコンドリア機能障害にも着目して、新しい心不全治療薬の開発に貢献する。
最終更新日:2021年10月01日
