分子薬理部
研究内容
研究分野1 ミトコンドリアエネルギー産生機構の鍵、チトクロムCオキシダーゼの活性調節メカニズムの解明と創薬展開
ミトコンドリアエネルギー産生機構の鍵 チトクロムCオキシダーゼ
生物は、食事などでとりこんだ有機化合物を、酸素を使ってエネルギーを取り出しATP(アデノシン3リン酸)に変換する機構をもっています。ヒトにもこのエネルギー産生機構が存在し、ミトコンドリアと呼ばれる細胞内小器官がエネルギー産生工場の中心的な場となっています。図に示すようにタンパク質複合体からなる5つの酵素が協調して働きATPを産生するメカニズムは、1900年台後半の生化学研究によりおおむね解き明かされたが、このエネルギー産生プロセスがうまく働かなくなる難病の治療法は未だにみつかっていません。この疾患が「ミトコンドリア病」とよばれる難病です。 ミトコンドリアはヒトの体を構成する、ほぼすべての臓器の細胞に存在します。エネルギーを産生する工場ですので、エネルギーをたくさん消費する臓器でその不全がより顕在化しやすく、中枢神経系、心臓、腎臓、骨格筋をはじめとした全身の複数の臓器に障害が生じます。心臓で臓器障害が強くでるタイプはミトコンドリア心筋症とよばれるミトコンドリア病の1病型として循環器領域の難病の一つとなっています。 最近、ミトコンドリアのエネルギー産生機構の異常が、拡張型心筋症をはじめとする心疾患、パーキンソン病を含む神経変性疾患、糖尿病や癌などさまざま疾患でみられ、その病態に関係している可能性が指摘されています。当研究室では、ミトコンドリア病の治療薬開発をめざし、チトクロムCオキシダーゼという酵素の研究を行っています。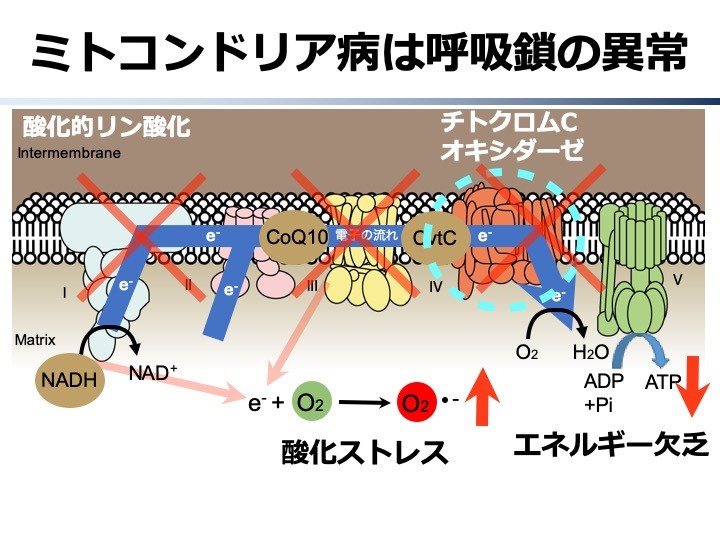
なぜチトクロムCオキシダーゼなのか?活性調節因子Higd1aの発見
私たちの研究グループは、ミトコンドリアにおけるエネルギー産生の新規調節分子(Higd1a)を発見し報告しました[1, 2]。Higd1aは低酸素環境で発現が誘導され、ミトコンドリアの呼吸鎖複合体IV(チトクロムCオキシダーゼ)に直接結合し、活性中心のヘム a周辺の構造をアロステリックに変化させることにより、オキシダーゼ活性を上昇させATP産生速度を上昇させることを明らかにしました。これらの事実は、ミトコンドリアエネルギー産生系において、チトクロムCオキシダーゼが律速酵素となる条件があること、さらに酸化的リン酸化によるエネルギー産生系が調節可能であることをはじめて証明したことになります。 そこで日本医療研究開発機構(AMED)の支援をうけ、この研究を発展させたチトクロムCオキシダーゼの活性調節剤の開発を進めています。化合物のハイスループットスクリーニングにより、細胞での呼吸鎖活性を上昇させ、ミトコンドリア病モデル細胞の細胞生存率を改善させる有望な候補化合物を取得しており、現在鋭意開発を進めています。当然これらの化合物は、心疾患でみられるエネルギー不全を改善させ、新たな治療薬となる可能性があります。
タンパク質の構造変化を読み解く重要性
私たちの研究室では、X線結晶構造解析およびクライオ電顕による単粒子解析を駆使して、化合物スクリーニングで発見した活性調節剤とチトクロムCオキシダーゼの構造解析に取り組み、すでに複数の複合体構造を得ています。これらの成果はチトクロムCオキシダーゼ活性調節の動作原理の解明につながるとともに、結合部位の同定と結合面の構造情報を得ることにより、合理的な化合物の改良につながります。創薬研究において特異性が高く、副作用の少ないリード化合物の創出を助け、成功確率をあげる重要なステップになります。
【参考文献】
1. Hayashi T, et al. Proc Natl Acad Sci U S A. 2015 Feb 3;112(5):1553-8.
2. Nagao T, et al. FASEB J. 2019 in press
最終更新日:2021年10月01日
