分子薬理部
分子薬理部
研究概要
タンパク質の構造と機能は生命現象の鍵であり、その異常、破綻がヒトの疾患の原因となります。タンパク質の機能と構造を理解するためには、タンパク質ごとに異なる性質にあわせて地道な実験を積み重ね、その本質を解き明かさなければいけません。 分子薬理部では、循環器疾患の制圧のため、治療標的分子の探索、その機能と疾患における破綻を、生化学、薬理学、遺伝学、分子生物学、構造生物学、計算化学などさまざま手法を駆使して解き明かし、新規治療法の創出を目指します。
研究テーマ
1. ミトコンドリアの呼吸鎖酵素、チトクロムc酸化酵素の活性調節と創薬展開
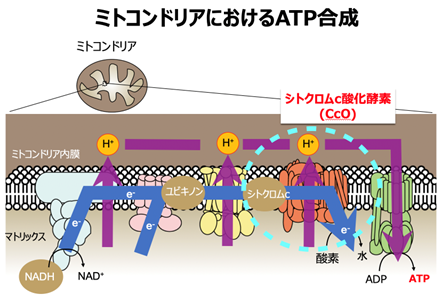
ミトコンドリアはヒトの体を構成するほぼすべての細胞に存在する、生体エネルギーであるATPを産生する工場です。このエネルギー産生系に支障が生じると、細胞障害・臓器障害につながり、ミトコンドリア病という先天性の代謝疾患を発症します。特にエネルギーをたくさん消費する臓器でミトコンドリア機能不全がより顕在化しやすく、中枢神経系、心臓、腎臓、骨格筋をはじめとした全身の複数の臓器障害が生じます。心臓で臓器障害が強くでるタイプはミトコンドリア心筋症とよばれるミトコンドリア病の1病型として循環器領域の難病の一つとなっています。また、ミトコンドリアのエネルギー産生機構の異常は、後天的にも生じ、拡張型心筋症をはじめとする心疾患、パーキンソン病を含む神経変性疾患、糖尿病や癌などさまざま疾患でみられ、病態の悪化に関係している可能性が指摘されています。
呼吸鎖・生体エネルギー産生機構を構成する酵素複合体は全部で5個あり、約100年近く研究されてきていますが、障害をおこしてしまった呼吸鎖の機能を上昇させることは不可能とされていました。
私達は、呼吸鎖酵素の1つであるチトクロムc酸化酵素の酵素活性を上昇させる分子を世界に先駆けて発見し(PNAS. 2015;112:1553, FASEB J. 2020;34:1859)、その知見をいかして、ミトコンドリア病、心疾患の治療薬開発をめざして、チトクロムc酸化酵素の活性化剤の開発を行っています。X線結晶構造解析およびクライオ電顕による単粒子解析を駆使して、独自に発見した活性化剤とチトクロムc酸化酵素の構造解析に取り組み、すでに複数の複合体構造を得ています。これらの成果は、構造創薬手法として、活性化剤の最適化を加速するのみならず、チトクロムc酸化酵素活性調節の動作原理の解明にもつながります。分子動力学シミュレーションにより、スナップショットである構造解析データに時間軸を加え、分光学的解析手法を組み合わせて、活性調節機構の解明を目指しています。
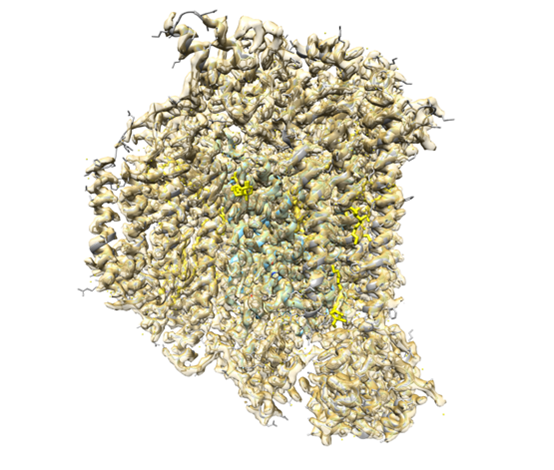
チトクロムc酸化酵素のクライオ電顕による単粒子解析(分解能〜2Å)
2. 呼吸鎖酵素に隠された阻害機構の解明〜病原菌特異的な新規抗菌薬の合理的創出を目指して〜
薬剤耐性病原菌は世界保健における一大脅威であり、薬剤耐性菌を原因とする年間死亡者数は2050年には1000万人を超え、人類の死因のトップになることが予測されています。現在、世界的に薬剤耐性(AMR: Antimicrobial resistance)が広がっており、有効な治療薬がなくなることが現実的脅威となっている病原菌が複数存在します。従来の抗菌剤の標的は、細胞壁合成阻害や核酸合成阻害など増殖期に有効ですが、一旦休止期となるような巧妙に生き残る菌を消失させることは困難であり、新規メカニズムによる抗菌剤の開発が強く求められています。呼吸鎖・生体エネルギー産生機構は休止期にも必須の機構ですが、これまで創薬標的とはなりませんでした。その一番の理由は、エネルギー産生機構は生物に共通の普遍的な機構であり、病原菌だけを特異的に標的とすることができないと考えられてきたからです。
この常識は、膜タンパク質の構造解析が進んだ結果くつがえされるようになっています。ヒトも病原菌も同じ機構(電子伝達と化学浸透共役)で、同じような酵素群を使ってエネルギー産生をおこないます。その酵素のコアの構造は驚くほど保存されています。しかし、真核生物にはコアの外側にサブユニットタンパクを加えて複雑さを増しています。すなわちタンパク質の形が、「似ているが異なる」のです。この構造の違いを利用すれば、病原菌の呼吸鎖・エネルギー産生だけ特異的に阻害する抗菌剤の開発が可能になります。
私達はこのアイデアで、上述したミトコンドリアのチトクロムc酸化酵素でためしてみました。生化学実験とクライオ電子顕微鏡を用いたタンパク質構造解析、計算化学、分子シミュレーションを集学的に組み合わせて、実際にヒト型チトクロムc酸化酵素には作用せず、淋菌標的酵素に特異的なアロステリック阻害剤を合理的に見出しました。さらに、既存の抗菌薬の効果がないスーパー耐性淋菌に有効な新規抗菌薬の創出に成功しました(Nat Commun. 2022;13(1):7591. Doi; 10.1038/s41467-022-34771-y, プレスリリース https://www.ncvc.go.jp/pr/release/pr_35763/)。

図 ヒトでは覆われたアロステリック部位を利用することで、ヒト型チトクロムc酸化酵素(左)には作用せず淋菌の標的酵素(右)のみを阻害する化合物を発見しました。この化合物は、ヒト細胞には作用せず、薬剤耐性淋菌に抗菌作用を持ちます。(発表論文より改変)
3. 心筋内炎症を制御する新規分子の探索
重症心不全や劇症型心筋炎において、体外循環によるメカニカルunloadingにより、心筋内炎症細胞浸潤を抑えられることが報告されており(Nat Rev Cardiol. 2020)、メカノストレスは心筋内炎症細胞浸潤に関与すると考えられます。しかしながら、メカノストレスが心筋内炎症細胞浸潤を惹起する分子メカニズムの解明は進んでいません。分子薬理部ではメカノシグナルと心筋内炎症をつなぐ新規膜タンパク質を同定しており、アンメットメディカルニーズのある遺伝性拡張型心筋症の非常に有望な創薬標的であることを明らかにしてきました。現在日本発のあらたな心疾患治療薬の開発を目指して、研究を進めております。
探索研究はラボのモットーで、あらたな創薬シーズ提案を継続的に行っています。
独自のHPも作成しています。よろしければご覧ください。
https://ncvc-molpharm.jp/
最終更新日:2023年02月09日
