分子病態部
研究内容
循環器疾患に関連する細胞機能に関する研究
循環器疾患に関連する細胞機能に関する研究
血中ホモシステイン濃度の上昇は、心血管系疾患の危険因子として知られています。以前に私たちは、ホモシステインが血管障害を引き起こすメカニズムを調べ、細胞の小胞体ストレスが障害に関与する可能性を見出すと同時に、機能未知の新規タンパク質NDRG1およびHerpを同定しました。以後、これらに関連する研究を続けています。
(A) 小胞体ストレスに関する研究
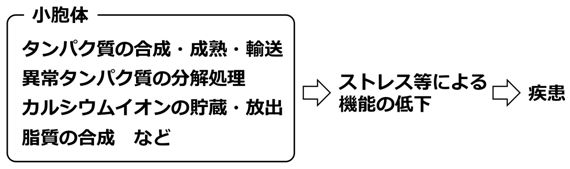
真核細胞の小胞体では分泌タンパク質や膜タンパク質が合成されますが、それらが正しく成熟できないと小胞体に過剰な負荷がかかります。これを小胞体ストレスと呼び、このとき種々の遺伝子の発現が誘導されます。私たちが発見した小胞体膜タンパク質Herpは、特に発現誘導が顕著な遺伝子産物として注目されています。最近、Herpは小胞体関連タンパク質分解(ERAD)で機能すると考えられるようになってきました。私たちは現在、Herp欠損マウスなどを利用して、Herpの機能解析を行っています。さらに、ERADにおいてHerpと協同的にはたらくタンパク質群の解析も進めています。
小胞体ストレスは、動脈硬化症や脳梗塞、糖尿病など、循環器関連の疾患に深く関わっている可能性が指摘されています。私たちは、小胞体ストレス応答機構やERADに関する基礎的研究を進め、その成果を医学分野で役立てることを目指しています。
【図:小胞体ストレスと疾患】
主な論文:
- Polycystin-2 is regulated by endoplasmic reticulum-associated degradation: Liang et al. Hum Mol Genet 17, 1109-1119 (2008)
- Evolution of the androgen receptor pathway during progression of prostate cancer: Hendriksen et al. Cancer Res 66, 5012-5020 (2006)
- Differential contributions of ATF6 and XBP1 to the activation of endoplasmic reticulum stress-responsive cis-acting elements ERSE, UPRE and ERSE-II: Yamamoto et al. J Biochem 136, 343-350 (2004)
- Endoplasmic reticulum stress-inducible protein, Herp, enhances presenilin-mediated generation of amyloid s-protein: Sai et al. J Biol Chem 277, 12915-12920 (2002)
- Identification of ERSE-II, a new cis-acting element responsible for the ATF6-dependent mammalian unfolded protein response: Kokame et al. J Biol Chem 276, 9199-9205 (2001)
- Herp, a new ubiquitin-like membrane protein induced by endoplasmic reticulum stress: Kokame et al. J Biol Chem 275, 32846-32853 (2000)
(B) NDRG遺伝子ファミリーに関する研究
私たちは、血管内皮細胞をホモシステインで処理すると発現誘導される遺伝子としてNDRG1(当初はRTPと命名)を発見しましたが、いくつかの研究グループにより、N-Myc遺伝子欠損胚で発現亢進する、ニッケルイオンや低酸素で発現誘導される、がん細胞を分化誘導させると誘導されるなど、様々な細胞の環境変化で発現量が変化する遺伝子としても報告されました。その後、NDRG1と一次構造が類似した遺伝子が次々に見つかりました。ヒトやマウスなどでは、4個の遺伝子NDRG1~NDRG4からなるファミリーを構成しています。NDRG1は多くの臓器で普遍的に発現しており、NDRG4は脳と心臓のみに強く発現するなど、それぞれの発現に特徴が見られます。
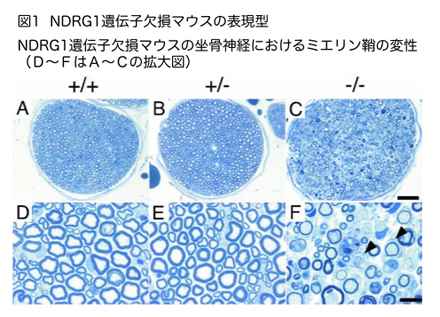
NDRG1遺伝子欠損マウスを作製したところ、生後2ヶ月頃から後肢に運動機能障害を示しました。NDRG1欠損マウスでは、坐骨神経のミエリン鞘はいったん形成されるものの、本来NDRG1が機能しているシュワン細胞が変性し、ミエリン構造を維持できなくなるために、神経変性が起こるようです(図1)。ヒトの先天性NDRG1遺伝子欠損症は、脱髄型の末梢神経変性疾患であるCharcot-Marie-Tooth 病4D型として報告されています。
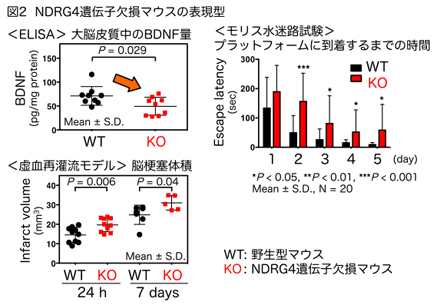
NDRG4欠損マウスでは、大脳皮質中の神経栄養因子BDNF量が減少していました。野生型に比べて記憶学習能力が低下しており、脳の虚血再灌流実験では、より大きな梗塞巣がみられました。このことから、NDRG4は、BDNF量を正常に保つことで、高次中枢機能や神経細胞保護に寄与していると考えられました(図2)。
現在、心血管系疾患との関連に注目しながら、さらに研究を進めています。
主な論文:
- NDRG4 protein-deficient mice exhibit spatial learning deficits and vulnerabilities to cerebral ischemia: Yamamoto et al. J Biol Chem 286, 26158-26165 (2011)
- Ndrg1 in development and maintenance of the myelin sheath: King et al. Neurobiol Dis 42, 368-380 (2011)
- Differential expression patterns of NDRG family proteins in the central nervous system: Okuda et al. J Histochem Cytochem 56, 175-182 (2008)
- Impaired mast cell maturation and degranulation and attenuated allergic responses in Ndrg1-deficient mice: Taketomi et al. J Immunol 178, 7042-7053 (2007)
- Ndrg1-deficient mice exhibit a progressive demyelinating disorder of peripheral nerves: Okuda et al. Mol Cell Biol 24, 3949-3956 (2004)
- Characterization of the human NDRG gene family: A newly identified member, NDRG4, is specifically expressed in brain and heart: Zhou et al. Genomics 73, 86-97 (2001)
- Phosphorylation of RTP, an ER stress-responsive cytoplasmic protein: Agarwala et al. Biochem Biophys Res Commun 272, 641-647 (2000)
- Homocysteine-respondent genes in vascular endothelial cells identified by differential display analysis - GRP78/BiP and novel genes: Kokame et al. J Biol Chem 271, 29659-29665 (1996)
(C) 血小板インテグリンの活性化機構に関する研究
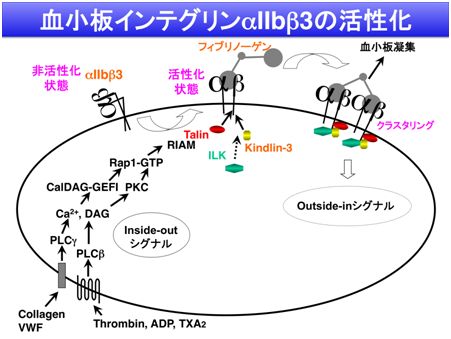
血小板凝集は血栓形成に中心的な役割を果たしており、血小板膜に存在するインテグリンαIIbβ3 は血小板凝集に必須のインテグリンです。血小板がトロンビンやADPなどの各種のアゴニストにより刺激を受けると、アゴニスト受容体からinside-out signal とよばれる細胞内の情報伝達がおこり、インテグリンαIIbβ3 が活性化型に変換されます。このαIIbβ3の活性化型は、タリンやキンドリンがβ3鎖の細胞内領域へ結合することにより、細胞外領域の立体構造変化を惹起して生じます。その結果、αIIbβ3はフィブリノーゲンやフォンビルブランド因子と結合できる構造を取ります。こうしてできた活性化型αIIbβ3は、リガンドであるフィブリノーゲンやフォンビルブランド因子と結合し、αIIbα3のクラスター化と共に、outside-in signalとよばれる情報が伝達され、強固な血小板血栓を形成します。このように、血小板インテグリンαIIbβ3の活性化は血小板血栓形成の極めて重要なステップであり、このメカニズムの解明は血小板凝集の人為的な制御法の開発に繋がります。タリンがインテグリンαIIbβ3の活性化に必須であることは2003年に示され、キンドリンの重要性は2008年に示されました。しかし、なおインテグリンαIIbβ3の活性化には未知の因子が関与すると考えられます。私たちは、この研究に取り組み、Integrin-linked kinaseがインテグリンαIIbβ3の活性化に関与することを明らかにしました。血小板インテグリンの活性化のメカニズムの更なる研究を通して、血小板血栓形成機構を解明し、人為的な血小板凝集制御法の開発を目指しています。
- Integrin-linked kinase associated with integrin activation: Honda et al. Blood 113, 5304-5313 (2009)
最終更新日:2021年10月22日
