分子病態部
研究内容
止血および血栓形成に関する研究
止血および血栓形成に関する研究
(A) 血栓性血小板減少性紫斑病の研究
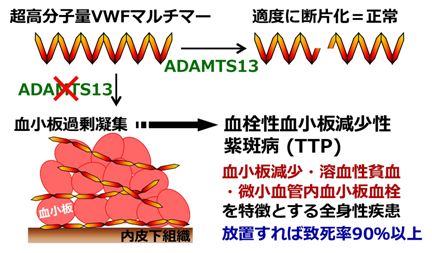
血栓性血小板減少性紫斑病は、細動脈に血小板血栓が生じ、そのため血小板数の減少と、それに伴う出血(皮下出血による紫斑)が見られる疾患です。脳の細動脈に血小板血栓が形成されると神経障害が見られ、腎の細動脈に血栓が生じると腎障害を引き起こします。厚生労働省の難治性疾患に指定された疾患です。血栓性血小板減少性紫斑病は、フォンビルブランド因子の切断酵素であるADAMTS13( a disintegrin-like and metalloprotease with thrombospondin type 1 motif, 13)の欠損により発症します。本症はADAMTS13遺伝子の先天性欠損症とADAMTS13に対する自己抗体(後天性)により発症します。私たちはこれまでに、先天性の血栓性血小板減少性紫斑病患者の遺伝子解析と確定診断、ADAMTS13活性の測定法の開発と実用化、ADAMTS13遺伝子改変マウスによる病態モデルの開発と解析、ADAMTS13の立体構造決定による基質認識機構の解明などを行ってきました。
【図:ADAMTS13の欠損による血栓性血小板減少性紫斑病の発症】
(A1) 先天性血栓性血小板減少性紫斑病患者の遺伝子解析
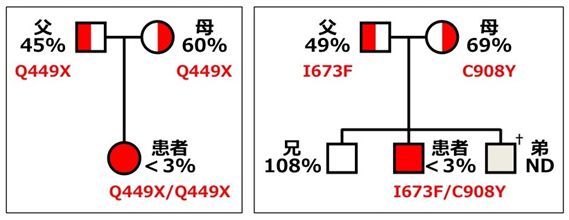
本邦で見いだされた先天性血栓性血小板減少性紫斑病(Upshaw-Schulman症候群)患者のADAMTS13遺伝子解析を進めています。これまでに、20家系以上の解析が終了しています。遺伝子解析による患者の確定診断の蓄積を通して、本疾患の臨床病型が明らかになってきました。詳しくは、Br J Haematol, 144(5), 742-754, 2009をご覧下さい。また、日本人の10人に1人が保有するP475S変異を見いだしました。血栓性血小板減少性紫斑病の発症に直接つながるものではありませんが、本変異保有者ではADAMTS13活性が少し低下するので、血栓性疾患発症の誘因になる可能性があるかもしれません。
【図:先天性血栓性血小板減少性紫斑病家系のADAMTS13遺伝子解析の例】
主な論文:
- Pregnancy-induced thrombocytopenia and TTP, and the risk of fetal death, in Upshaw-Schulman syndrome: a series of 15 pregnancies in 9 genotyped patients: Fujimura et al. Br J Haematol 144, 742-754 (2009)
- Inherited and de novo mutations of ADAMTS13 in a patient with Upshaw-Schulman syndrome: Kokame et al. J Thromb Haemost 6, 213-215 (2008)
- Genetic defects leading to hereditary thrombotic thrombocytopenic purpura: Kokame & Miyata. Semin Hematol 41, 34-40 (2004)
- Mutations and common polymorphisms in ADAMTS13 gene responsible for von Willebrand factor-cleaving protease activity: Kokame et al. Proc Natl Acad Sci, USA, 99, 11902-11907 (2002)
(A2) ADAMTS13活性測定法の開発と実用化
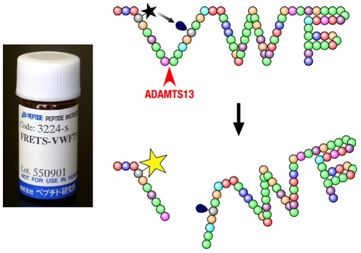
ADAMTS13は血漿中に存在するメタロプロテアーゼです。その酵素活性の極端な低下(5%以下といわれる)により、血栓性血小板減少性紫斑病が発症します。多くの場合はADAMTS13タンパク質に対する自己抗体の産生による活性の低下(後天性)ですが、ADAMTS13遺伝子の変異による活性の低下(先天性)もあります。血栓性血小板減少性紫斑病は、大腸菌O157が産生する志賀毒素で起こる溶血性尿毒素症候群と症状が似ているので、両疾患をあわせて血栓性細小血管障害症と呼びます。血栓性血小板減少性紫斑病の確定診断には、ADAMTS13の活性測定が重要です。私たちは、ADAMTS13のプロテアーゼ活性を測定する蛍光基質FRETS-VWF73の開発に成功しました。FRETS-VWF73を用いると約20分で血漿のADAMTS13活性を測定できます。本基質は血栓性血小板減少性紫斑病の診断や、ADAMTS13がかかわると考えられる疾患の診断に、世界中で用いられています。
【図:消光性蛍光基質FRETS-VWF73を利用したADAMTS13活性測定】
主な論文:
- FRETS-VWF73, a first fluorogenic substrate for ADAMTS13 assay: Kokame et al. Br J Haematol 129, 93-100 (2005)
- VWF73, a region from D1596 to R1668 of von Willebrand factor, provides a minimal substrate for ADAMTS-13: Kokame et al. Blood 103, 607-612 (2004)
(A3) ADAMTS13遺伝子改変マウスの解析
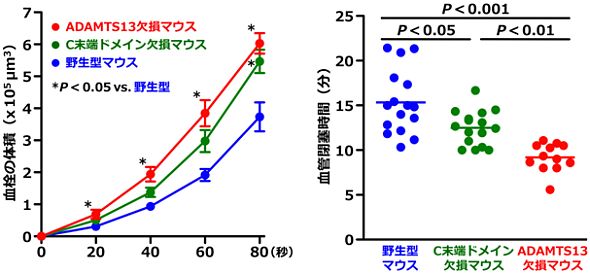
血栓性血小板減少性紫斑病の研究にはマウスモデルが必要です。私たちは先天性ADAMTS13欠損マウスの作製に成功しました。このマウスは血栓性血小板減少性紫斑病を自然発症することがなく、ヒトの先天性欠損症とは異なる表現型を示しましたが、血小板血栓形成能は亢進していました。また研究の過程で、レトロトランスポゾンの挿入変異により、C末端ドメイン欠損型ADAMTS13を持つマウス系統を同定しました。このマウスの血栓形成能は全長型ADAMTS13を持つ野生型マウスに比べて亢進していました。
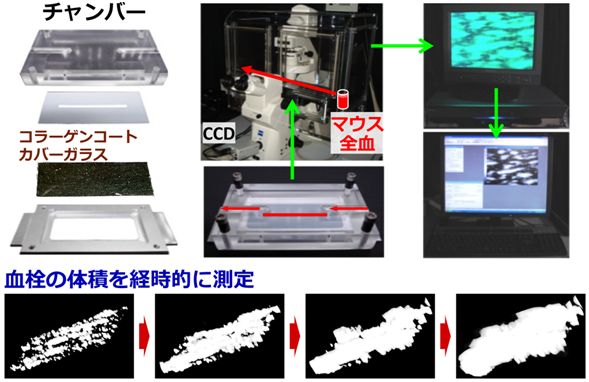
【図:ADAMTS13遺伝子改変マウスの血栓形成能】
[左図]ずり応力下血小板血栓形成能:次に示す装置を使用し、ずり速度5000 s-1で測定(平均値±SEM,N=15)
[右図]血管傷害部位での血小板血栓形成能:マウス腸間膜動脈にFeCl3溶液を塗布することで血小板血栓形成を誘発し、血栓により血管が閉塞するまでの時間を測定
血栓症を示すマウスの解析には、幾つかの装置が必要ですが、私たちは動脈内の血流下で生じる「ずり応力」を勘案した「ずり応力下血小板血栓形成観察装置」を用いています。この装置は、全血中の血小板を蛍光ラベルし、コラーゲン表面上での血栓形成を定量的に観察できる装置です。遺伝子改変動物の血小板血栓形成能をお調べになりたい研究者がおられましたら、御連絡下さい。
【図:ずり応力下血小板血栓形成観察装置(平行板型フローチャンバーシステム)】
主な論文:
- ADAMTS13 gene deletion aggravates ischemic brain damage: a possible neuroprotective role of ADAMTS13 by ameliorating postischemic hypoperfusion: Fujioka et al. Blood 115, 1650-1653 (2010)
- The distal carboxyl-terminal domains of ADAMTS13 are required for regulation of in vivo thrombus formation: Banno et al. Blood 113, 5323-5329 (2009)
- Complete deficiency in ADAMTS13 is prothrombotic, but it alone is not sufficient to cause thrombotic thrombocytopenic purpur: Banno et al. Blood 107, 3161-3166 (2006)
- Identification of strain-specific variants of mouse Adamts13 gene encoding von Willebrand factor-cleaving protease: Banno et al. J Biol Chem 279, 30896-30903 (2004)
(A4) ADAMTS13の立体構造と基質認識機構の解明
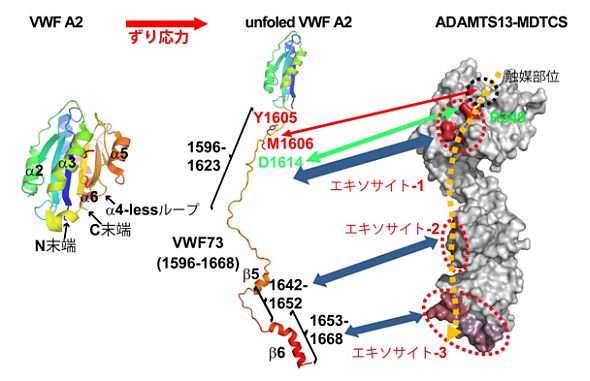
ADAMTS13は、血中の超高分子量フォンビルブランド因子多量体を適度な大きさに断片化することにより、過度な血小板凝集を抑制しています。ADAMTS13はN末端から、メタロプロテアーゼ(M)メイン、ディスインテグリン様(D)ドメイン、TSP-1 type-1 repeat(T、 T1)ドメイン、Cys-rich(C)ドメイン、スペーサー(S)ドメイン、7つのT1ドメイン、2つのCUBドメインから構成されています。私たちはADAMTS13の厳密な基質特異性(2,250残基のフォンビルブランド因子のたった1箇所のペプチド結合だけを切断する)の構造要素を明らかにする目的で、ADAMTS13のDTCS領域(残基番号297-685)の立体構造を決定しました。その結果、ADAMTS13は複数のエキソサイトを通して、ずり応力等でほどけたフォンビルブランド因子を広範囲(少なくとも3箇所)で認識し、フォンビルブランド因子に対する特異的な親和性を高めていました。DTCS領域の立体構造はADAMTSファミリー内で保存されていると考えられますので、複数のエキソサイトを介したADAMTS13の基質認識機構は、ADAMTSファミリーの高い基質特異性を説明すると考えています。
【図:ADAMTS13-DTCSの結晶構造[PDB 3GHM]のリボン表示】
橙色:Dドメイン、空色:T1ドメイン、緑色:CAドメイン、赤色:C Bドメイン、紫色:Sドメイン
![1-1-4)図:ADAMTS13-DTCSの結晶構造[PDB 3GHM]のリボン表示](/res/divisions/etiology/images/zi1-1-4-1.gif)
【図:ADAMTS13-MDTCSとVWF A2ドメインの相互作用モデル】
静的状態ではADAMTS13の切断部位(Tyr1605-Met1606)はVWF A2ドメインの内部に埋もれています。VWF A2ドメインはVWF A1およびA3ドメインのα4に対応する領域がαへリックス構造をとらない(α4-lessループ)のでunfoldしやすいと考えられています。VWFが血管内で高いずり応力にあうと、A2ドメインのC末側がunfoldし、切断部位とエキソサイト結合領域が露出し、広範囲でVWFとADAMTS13が相互作用します。その結果、特異的な親和性が高まり、効率的な切断が起こると考えられます。
主な論文:
- Crystal structures of the noncatalytic domains of ADAMTS13 reveal multiple discontinuous exosites for von Willebrand factor: Akiyama et al. Proc Natl Acad Sci, USA, 106, 19274-19279 (2009)
(B) 日本人の血栓性素因の研究
血栓症は多因子疾患であり、さまざまな環境因子に遺伝因子が絡まり発症します。私たちは、2006年に静脈血栓塞栓症の遺伝因子として、PROS1(プロテインS)遺伝子のK196E変異を同定しました。本変異ヘテロ接合体は、日本人の約55人に1人、ホモ接合体は約12,000人に1人と計算されます。頻度が高いので、臨床上重要な変異と考えています。本変異は白人種にはないようです。本変異ヘテロ接合体は、プロテインS活性の低下(平均16%の低下)を示すものの、その活性値は広い分布を示し、正常人の活性値と大きくオーバーラップすることから、活性測定だけでは本変異の有無を判定できません。これまでに、プロテインS K196E変異のホモ接合体はわずか3名しか同定されていませんが、いずれも静脈血栓塞栓症を発症した患者に同定されています。静脈血栓塞栓症患者の治療方針に遺伝性の素因情報を生かす試みをしています。
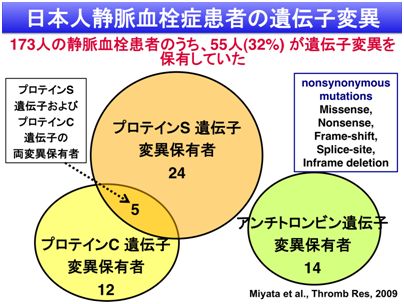
日本人の静脈血栓塞栓症患者173名のアンチトロンビン、プロテインC、プロテインSの遺伝子を調べたところ、55名(約32%)に39種のアミノ酸変異を伴う変異を同定しました。なかでも、プロテインS K196E変異が最も多く15名に見られ、次いで4名ずつの患者に、プロテインCのK193del変異とV339M変異を同定しました。日本人にはこういった変異が多く見られ、血栓症発症リスクを高めているようです。興味あることに、プロテインC K193del変異保有者のプロテインCアミド活性は正常値を示しますが、抗凝固活性は低値を示します。静脈血栓塞栓症患者では、抗凝固活性を測定することが重要です。


主な論文:
- Prevalence of genetic mutations in protein S. protein C and antithrombin genes in Japanese patients with deep vein thrombosis: Miyata et al. Thromb Res. 124, 14-18 (2009)
- Protein S-K196E mutation as a genetic risk factor for deep vein thrombosis in Japanese patients: Kimura et al. Blood 107, 1737-1738 (2006)
- Plasma protein S activity correlates with protein S genotype but is not sensitive to identify K196E mutant carriers: Kimura et al. J Thromb Haemost. 4, 2010-2013 (2006)
- Genetic risk factors for deep vein thrombosis among Japanese: importance of protein S K196E mutation: Miyata et al. Int J Hematol. 83, 217-223 (2006)
トロンボモジュリン遺伝子:トロンボモジュリンは、血管内皮細胞に恒常的に発現しており、凝固反応で生じたトロンビンに結合し、トロンビンがプロテインCを活性化する際のコファクターとして働きます。ですから、トロンボモジュリンの活性低下は静脈血栓塞栓症に繋がる可能性があります。私たちは、トロンボモジュリンのA455V変異を含むハプロタイプが、男性・女性共に可溶性トロンボモジュリン量と関連を示し、男性で静脈血栓塞栓症に関連を示すことを明らかにしました。本多型と可溶性トロンボモジュリン量との関連は、米国の研究でも見られましたが、静脈血栓塞栓症との関連は他の研究では確認されていませんので、慎重に検討する必要があると思います。
組織因子経路インヒビター遺伝子:組織因子経路インヒビターは組織因子経路の凝固反応を抑制するので、本因子の活性低下は静脈血栓塞栓症の素因となる可能性があります。組織因子経路インヒビターはα型とβ型があります。β型はAsn221がglycosylphosphatidylinositolで修飾され血管内皮細胞の表面に係留します。私たちはβ型のAsn221残基のSerへの変異を同定しました。この変異体を持つヒトの血中組織因子経路インヒビター量を調べたところ、Serに変異すると血中量が増しており、変異組織因子経路インヒビターは細胞の表面に係留されないことが分かりました。しかし、本多型と静脈血栓塞栓症には、有意な関連を見いだしませんでした。本変異保有者の内皮細胞表面の抗血栓性は低下していると考えられますので、ある種の病態下では、血栓の発症にかかわるかもしれません。
主な論文:
- Association of Asn221Ser mutation in tissue factor pathway inhibitor-b with plasma total tissue factor pathway inhibitor level: Ishikawa et al. Blood Coagul Fibrin 20, 22-26 (2009)
- Haplotype of thrombomodulin gene associated with plasma thrombomodulin level and deep vein thrombosis in the Japanese population: Sugiyama et al. Thromb Res 119, 35-43 (2007)
最終更新日:2021年10月22日
