先端医療技術開発部
Ⅰ. 概要
先端医療技術開発部は、2020年に創立された比較的新しい研究部で、主に先端的な生体イメージング機器を駆使した循環器の基礎研究、および前臨床研究を行っている。創立当初は、望月直樹が併任部長を務め、2020年4月から研究室長として超高磁場MRIを担当する斎藤、2022年4月にはタンパク質立体構造解析とRI実験施設の管理運営を担当する武田、同年9月には組織特異的な血管病態や細胞の分子活性測定解析を担当する山城が所属し、同年11月から藤原祥高が部長を務めている。
極めて動的な生体器官である循環器について、その機能や病態を深く理解するためには、生体の循環器を高い時間分解能で、できる限り高い空間分解能で観察できることが望ましい。また、刻々と変化する状況に対応して生じる細胞内の分子活性を抽出することも、病態分子機構の理解に有益である。当部では、ゲノム編集を介した実験動物に対して、超高磁場7T-MRIを用いた病態モデル解析と多光子顕微鏡、タイムラプス蛍光顕微鏡を用いた単一細胞解像度の分子活性イメージングを行っている。イメージングを用いた脳血管疾患および循環器疾患の病態解明や先端的な研究技術の開発を目指して研究を行っている。
Ⅱ. 業績内容
研究業績
- 超高磁場7T-MRIを用いた先端画像技術の開発(齋藤室長)
我々は30cmボアを有する超高磁場7T-MRIを前臨床・基礎研究に利用し、疾患モデル動物の病態解明を進めている(図1)。本装置はマウスから小型の霊長類までの測定が可能で、撮影技術開発を通じて基礎と臨床をつなぐ橋渡し研究を推し進めている。
図1 7T-MRI - 脳疾患モデルへの先端画像技術の開発とその適用
脳疾患には脳梗塞や脳出血などの脳血管障害(図2)、パーキンソン病、アルツハイマー病などの神経変性疾患、多発性硬化症などの脱髄疾患、神経膠芽腫などの脳腫瘍などがある。現在、MRIはこれらの脳疾患に対して、最も有効な画像診断技術となっており、既存の解剖学的な評価法に加え、水分子拡散イメージング(DTI、NODDI)、脳代謝物イメージング(MRS、CEST)、脳血管や脳血流イメージング(MRA、 ASL)などの多面的なイメージング技術を積極的に応用し、より詳細に病態診断や治療効果判定を可能とする新たな画像バイオマーカーの探索を目指している。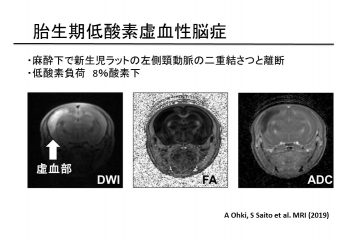
図2 胎児期低酸素脳症のMRI - 心疾患モデルへの先端画像技術の適用
臨床で用いられている心臓の画像診断技術は心臓の拡張や収縮に伴う容積や形態的な変化を捉えることで心機能や心筋の病態を評価している。そのため心臓の形態変化が起きる前の早期病変や形態変化を伴わない疾患の評価は困難である。超高磁場7T-MRIを用いて齧歯類の心臓に対して、100μm以下の高分解能で心機能イメージングや心筋組織性状イメージング法の開発を行い、心疾患モデルの発達に伴う心臓の形態変化(図3)、心疾患病態の早期検出、形態変化を伴わない心筋組織変性の検出を目指している。現在までに、マウスの心筋壁厚マッピングの開発(MRI 2017)、拡張型心筋症モデルにおける心機能低下の早期検出(Sci Rep 2017)、心臓内の線維芽細胞が心臓の線維化・硬化をもたらす筋線維芽細胞に変化する過程を明らかにしました(Circulation research 2019)。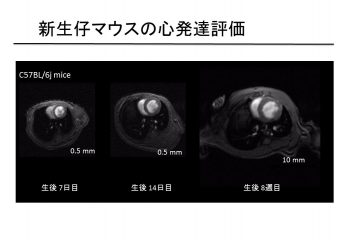
図3 新生仔マウスの心発達過程のMRI画像
- 脳疾患モデルへの先端画像技術の開発とその適用
- イメージング技術を用いた組織特異的な血管病態のリアルタイム解析(山城室長)
血管壁は様々なメカニカルストレス(血圧や血流による血行力学応力)に晒されながら、血管壁の恒常性を維持しており、その制御機構の破綻が血管病態発生の根本原因ではないかと注目されている。細胞が外力を感知し、応答する仕組み(メカニカルストレス応答)とそのシグナル伝達(メカノトランスダクション)は、細胞接着斑を介して細胞内に伝達されるが、その制御メカニズムの詳細は未だ不明である。とりわけ、(1) 細胞外環境(細胞外マトリクスの分泌・分布、剛性、作用)の変化、(2) 細胞内のシグナル伝達経路、(3) 病態発生に起因する細胞機能の変化、の3者がどのような連動性を持って制御されているのか?は、全くの不明である。
山城はこれまでに、血管病態発生に関与する細胞内シグナル伝達経路が、メカニカルストレス応答に起因することを明らかにしてきた(Yamashiro. Sci. Signal., 2015、Yamashiro. Circ. Res., 2018)。また、血管平滑筋細胞において、ストレッチ刺激に伴って分泌される細胞外マトリクスThrombospondin-1 (Thbs1)が細胞接着斑に作用し、低分子量Gタンパク質Rap2の不活性化とメカニカルストレス応答性の転写調節因子YAPの核内移行を制御し、血管圧負荷における血管壁のリモデリングや、血管狭窄時の新生内膜形成に重要な働きを担う知見を見出した(Yamashiro. PNAS., 2020)。直近の成果として、頸動脈結紮による血管狭窄は、部分的な内皮間葉転換(Partial EndMT)機構が‘関与することや、Partial EndMTの分子メカニズムも明らかにしている(Yamashiro et al. Cardiovasc Res., 2023)。
血管病態の分子機構を可視化し、生体反応をリアルタイムで制御することを目標として、多光子顕微鏡やタイムラプス蛍光顕微鏡を駆使し、病態発生を高分解能で解析する技術開発を担当する。 - タンパク質立体構造解析とRI実験施設の管理運営(武田室長)
- タンパク質立体構造解析
タンパク質の機能破綻は様々な疾患の原因となる。疾患に関係したタンパク質分子の立体構造を知ることや疾患に繋がる遺伝子変異によるアミノ酸置換等を分子構造上にマッピングすることで、分子の機能異常や疾患の原因を特定できる。循環器疾患に関連したタンパク質のX線結晶構造解析法などによる実験的な構造決定やAlphaFold2などによる予測構造モデルの検証を行い、サブナノメートル分解能でのタンパク質分子の振舞と異常を知ることから疾患原因の解明を目指す研究を行っている。 - RI実験施設の管理運営
動物実験施設の一角は非密封RIを用いた実験が可能な放射線管理区域となっている。法令に基づいた施設の管理運営とトレーサー実験等の支援業務を行っている。
- タンパク質立体構造解析
Ⅲ.今後の展望
MRIを用いる研究では、ゲノム編集技術を加えた齧歯類から中大動物への展開を目指し、臨床への橋渡し研究を加速する多光子顕微鏡やタイムラプス蛍光顕微鏡を用いた研究では、病態発生の根幹となる分子機能や細胞-細胞間相互作用、細胞外環境の変化を可視化・定量化し、「病態を可視化する」ことを目標に、治療介入の基盤技術を創出する。これらの研究を通じて、循環器病態の理解の時空間的解像度を高めていく研究を目指す。
最終更新日:2024年02月27日
