- 重要なお知らせ
- 一覧を見る
各部の紹介About
研究所からのお知らせNews
-

- トピックス
- 症状が出る前から進行する『静かな多臓器老化』の正体
-

- トピックス
- Tokyo Biodesign Healthtech Innovation day 2025のピッチイベントにおい……
-

- トピックス
- 難病『ミトコンドリア心筋症』の進行メカニズムを発見 ―患者とモデルマウス研究の統合による病態解明―
-

- トピックス
- 我が国の国民健康保険加入者の定期健診受診と糖尿病および透析リスクに関する新たな研究知見
-
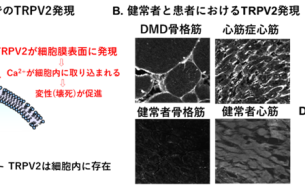
- トピックス
- 抗アレルギー薬が心不全と筋ジストロフィーの新たな希望に!
-

- トピックス
- SMK音声による認知症診断支援アルゴリズムの共同研究・開発が完了
-

- トピックス
- バイオデジタルツイン研究部/循環動態制御部 上村 和紀 が第62回日本人工臓器学会大会で大会賞 優秀賞を受賞
-

- トピックス
- ゼブラフィッシュの房室管の心筋細胞は 冠血管の形成を調節する
