Division of Arrhythmia
電気生理学的検査・カテーテルアブレーション
電気生理学的検査・カテーテルアブレーション
頻脈性不整脈は、その発生を予測することが困難で、突然の動悸、胸痛や意識消失といった、患者様にとって強い不安や不快感を伴う疾患です。さらに心室頻拍や心室細動などの致死的不整脈では、初回の発作が生命を奪うこともまれではありません。これらの不整脈は、しばしば薬剤抵抗性であり、また抗不整脈薬治療では、血中濃度の治療域と中毒域が比較的近接しており、慎重に副作用の有無を観察する必要があります。
医療技術の進歩は、不整脈の診断、治療を一変させました。中でもカテーテルアブレーションは、根治困難であった不整脈の治療に絶大な力を発揮するようになりました。
80年代の後半、まだ我国のアブレーション治療の黎明期に、先駆者としてスタートした当センターでのカテーテルアブレーション治療は、すでに30年以上の歴史を誇っています。国内で現在活躍する多くの傑出した人材を輩出するとともに、日本国内のみならず、世界に向けて情報を発信し続けています。
図1. 電気生理検査、アブレーション件数の推移
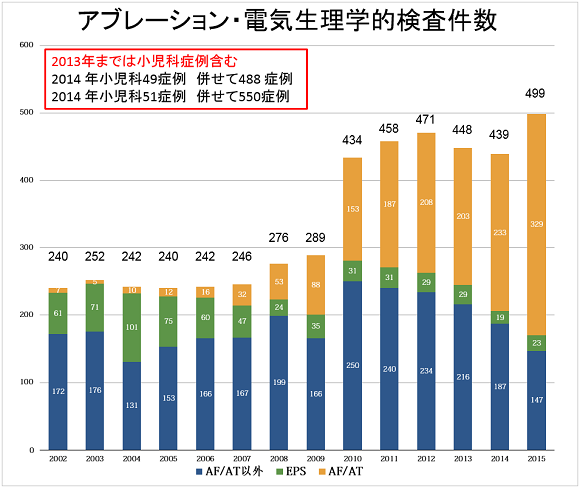
図2. カテーテル検査の風景

電気生理学的検査の役割
電気生理学的検査(EPS:Electrophysiological study)には、以下の3つの役割があります。
- カテーテルアブレーションのための不整脈のメカニズム診断、至適治療部位の決定
- 致死的不整脈の予後評価、治療方針決定
- 薬物治療の薬効性判定
カテーテルアブレーションが一般的になりつつある現在、EPSとアブレーションはほぼ同時に行われるようになっています。
カテーテルアブレーション
カテーテルアブレーションにおけるEPSの役割は、頻拍の機序を診断し、至適治療部位を決定することです。
頻拍性不整脈の機序は、異所性自動能、撃発活動、リエントリに分けられます。さらにリエントリはその興奮が一定の頻度で、決まった回路において持続する解剖学的リエントリ(ordered reentry)、及び興奮頻度も回路もばらばらな機能的リエントリ(random reentry)に分けられます。異所性自動能、撃発活動及び比較的小さなリエントリでは、そのメカニズムを問わず、頻拍は心筋組織の限られた部位から心筋全体に興奮が伝播する巣状興奮パターンをとります。従って心腔内の最早期興奮部位が頻拍の起源であり、それがアブレーションのターゲットとなります。
図3. 主な不整脈のメカニズム
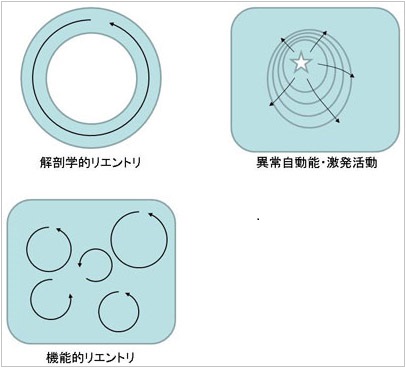
特定の構造を開始し興奮が旋回する解剖学的リエントリ(Ordered Reentry)。心筋局所の機能的変化により旋回路が形成されるため、1心拍ごとに旋回路が変化する不安定な機能的リエントリ(Random Reentry)。局所的な興奮が同心円状に伝播していく場合は異常自動能、撃発活動及び小さなリエントリ(マイクロリエントリ)が考えられるが、臨床上は鑑別が困難なことが多い。
解剖学的リエントリ、特に大きな回路を有するマクロリエントリによる頻拍は、心房ないし心室内、及び双方で比較的大きな回路を形成しており、どの部分をターゲットにアブレーションを行うかが、アブレーションの成否に関わっています。どの部位をアブレーションするにしろ、理論的にはその回路を遮断するように伝導ブロックを作れば、頻拍は停止するはずですが、通常、解剖学的に回路上のもっともアブレーションの容易な部分、すなわち峡部(isthmus)を見いだすことが重要になります。
アブレーション至適部位は頻拍によりそれぞれ異なりますが、頻拍のメカニズムを診断すれば、その解剖学的部位が規定されているため、自ら通電部位が決定するものと、頻拍中のマッピングにより峡部を見いだす必要があるものに分けられます。
A.解剖学的リエントリに基づく頻拍のアブレーション
発作性上室性頻拍(PSVT)のうち、副伝導路に伴う房室リエントリ性頻拍では、その治療のターゲットは副伝導路の遮断であり、房室結節の二重伝導路に伴う房室結節リエントリ性頻拍(AVNRT)は遅伝導路(slow pathway)のアブレーションにより根治します。これらのアブレーション至適部位の位置はある程度解剖学的に規定されています。一方で、陳旧性心筋梗塞に伴う心室頻拍では、梗塞部周辺の瘢痕組織間の伝導遅延部位を峡部として頻拍回路は形成されているため、頻拍中にマッピングを行い、この回路の必須緩徐伝導部位を見つけ出す必要があります。
このような解剖学的リエントリにおいては、その回路が遮断できれば、100%頻拍を根治することができます。不成功となるのは、診断が不十分で治療部位が誤っているか、心筋の厚みや解剖学的な構造のため、貫壁性の焼灼ができず、伝導が遮断できないためと考えられます。
心室頻拍では、血圧低下のため、頻拍中にその、メカニズムを調べることはしばしば困難です。最近では、3次元マッピング装置を使用し、洞調律中に、頻脈の原因となりうる心筋の異常な部分を同定し、洞調律中にアブレーションを行うことで、心室頻拍を抑制できうるようになりました。また厚みを持つ心室筋においては、血管を通して心内膜側から治療を行う従来の方法では、アブレーション効果が及ばず、治療困難なことがあります。近年、心窩部から経皮的に穿刺し、心嚢内にカテーテルを挿入することで、低侵襲に心外膜側からのアブレーションができるようになりました。これら方法により、これまで困難とされていた、心室頻拍も根治可能になってきています。
図4. 3次元マッピング装置によるマクロリエントリ性心房頻拍の診断
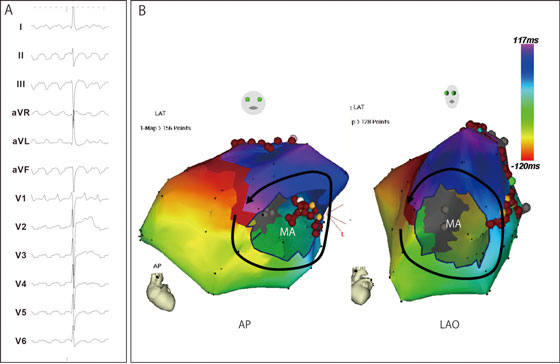
3次元マッピング装置(CARTO)を用いて、左房をマッピングした例。僧帽弁(MA)周囲を旋回する興奮パターンを示す。
図5. 心外膜アブレーション
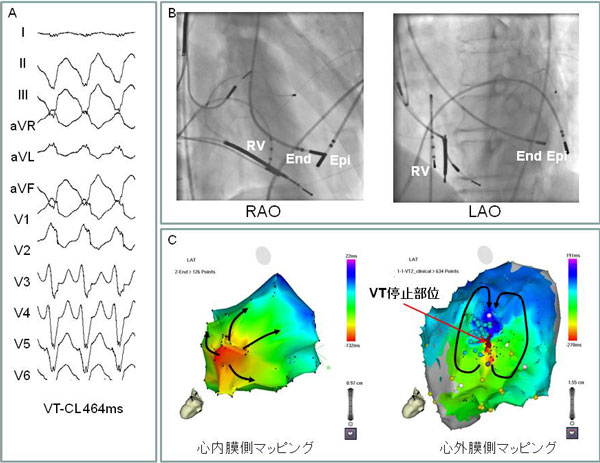
心窩部からの穿刺により、低侵襲で心外膜(Epi)にカテーテルを挿入できるようになり、心内膜側(End)からでは治療困難であった、心外膜側起源の心室頻拍(VT)を根治することが可能になった。心内膜ではVTの興奮パターンは巣状興奮パターンを示し、心外膜では8の字型リエントリを示している。VT回路の必須緩徐伝導部位は心外膜側に存在する。
B.機能的リエントリに基づく頻拍のアブレーション
一方で、近年アブレーションが積極的に試みられている心房細動では、これまでのアブレーションの基本的考え方とまったく異なるコンセプト、アプローチで行われています。
心房細動(AF)のアブレーションのターゲットは頻拍そのものよりは、その発生のトリガーとなる心房期外刺激の主な起源であるとともに、AF中の高い興奮頻度により、その維持にも関わっている肺静脈(PV)と心房とを遮断することにあります。
AFのリエントリは心房内に同時に多数存在し、常に興奮伝播は変化しているため、AFのリエントリ回路を遮断するための、絶対的なターゲットは存在しません。例え通電中にAFが停止したとしても、アブレーション後、誘発可能なことも多いことがそれを裏付けています。
しかし発作性AF、ないし1年以内の持続性AFでは、PVの隔離のみで80~90%は洞調律維持が可能です。AFの発生・維持におけるPVの役割の重要性が、様々なアブレーション治療の報告により再認識されるようになったとともに、PVを確実に隔離することが、AFの治療上極めて重要なポイントといえます。
またAFと同様、機能的リエントリである心室細動(VF:Ventricular fibrillation)はカテーテルアブレーションに残された最後の難関です。現在、心室細動のトリガーとなる心室期外収縮が、常に同じであるような、限られた心室細動例については、アブレーションが可能となっています。
図6. 心房細動のアブレーション(肺静脈隔離術)
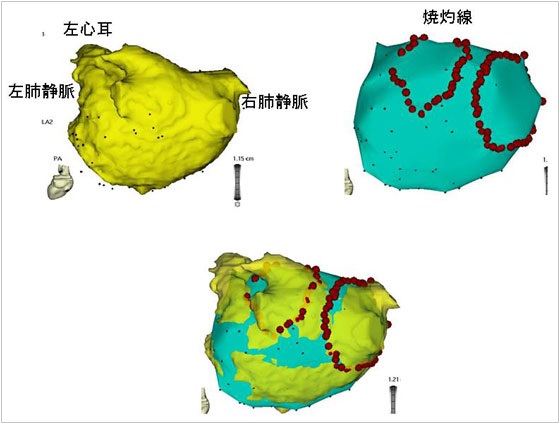
3次元マッピングと3D心臓CTを組み合わせ、心臓の解剖をより正確に把握し、治療することが可能になった。
致死的不整脈の予後評価
植込み型除細動器(ICD:Implantable Cardioverter-Defibrillater)は、心室頻拍(VT:Ventricular tachycardia)、及びVFによる突然死を予防する治療機器です。心腔内に留置したリードを介し、患者様の心拍数を常時観察し、頻拍が発生した際に、抗頻拍ペーシング(オーバードライブ)や電気ショックで頻拍を停止さます(デバイス治療の項参照)。ICD治療は、致死的心室性不整脈の既往のある患者様において予後改善効果が認められています(2次予防)。さらに致死的不整脈発生の独立した危険因子である低心機能の患者様において、不整脈の既往にかかわらず、ICDが予後を改善させることが明らかになってきています(1次予防)。しかしICD治療では、植え込みの合併症や誤作動など、経過観察中のトラブルが一定の頻度で発生します。さらに医療経済の立場からも、すべての低心機能患者様に一律にICDを適応することは困難です。どのような患者様が突然死の可能性が高いかを見極めるための方法として、24時間心電図、運動負荷心電図、加算平均心電図、など非侵襲的な方法と、ペーシングにより心室性不整脈の誘発性を評価する、EPSが試みられています。
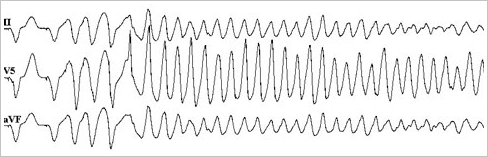
心室性不整脈に対するEPSは右室心尖部ないし右室流出路に電極カテーテルを経静脈的に留置し、ペーシングにより期外刺激ないし頻回刺激を行いVT/VFの誘発を試みます。通常心室の不応期(心室が捕捉される最短連結期)まで、期外刺激ペーシングを行います。
心筋梗塞後などに発生する、ほぼ固定したリエントリ回路を有するVTについては、EPSにより再現性をもって頻拍が誘発されることが多く、薬剤投与やアブレーションにより誘発不能になれば、治療効果があったと判断できます。一方で拡張型心筋症、肥大型心筋症では多型性心室頻拍や心室細動などの非特異的な頻拍が誘発されることが多く、その予後判定効果の特異度、感度とも十分ではありません。さらに最近検診などで見いだされることが多くなってきている無症候性Brugada症候群においてはEPSによるVF誘発と予後の関係には、否定的な報告もあります。これらの疾患でのEPSによる予後判定は容易ではなく、病歴や非侵襲的検査の結果もふまえ、総合的に判断することが求められています。
図7. 心室細動の誘発
薬物治療後の薬効性評価
心筋梗塞既往患者様においてフレカナイド(タンボコール)など、陰性変力作用の強いI群抗不整脈が予後を増悪させることを示したCAST試験以後、器質的心疾患患者様のVT/VFに対してはアミオダロン(アンカロン)やソタロール(ソタコール)など陰性変力作用の少ないⅢ群薬が主に用いられるようになっています。アミオダロンと比較して、ICDの有意な死亡率改善効果が示されたAVID試験以後、致死的不整脈の治療はICDに委ねられるようになりました。
日本循環器学会によるICD植え込みのガイドラインは、薬物無効性のVT/VFをICD適応のクラスⅠ(治療のエビデンスが大規模試験で確立されている)としています。薬剤の有効性の判定は、治療後に行うEPSによるVT/VFの誘発性、ないしHolter心電図における心室期外収縮ないし非持続性VTの減少ないし消失が用いられます。
現在は薬剤の効果にかかわらず、VT/VF既往患者様にはICDが用いられることが多くなっており、ICDの作動の有無をもって薬効評価を行うことが可能で、EPSによる薬効評価の役割は低下しつつあります。
このように、不整脈の治療においては、 EPSの適応を良く理解した上で実施することにより、患者様ごとの至適な治療方針の決定が可能です。また適切な電気生理学的診断に基づいたカテーテルアブレーションにより、これまで治療困難と考えられていた頻脈の根治が期待できます。
コラム1
| リエントリ | 通常の興奮伝播は、刺激伝導系を介して、心房-房室結節-心室と一方向に伝導していき、最終的に興奮は消失する。リエントリでは、その回路を興奮が永続的に回り続けることで頻拍が持続する。 |
|---|---|
| 異常自動能 | 洞結節以外にも自発的な興奮を行えうる部位が存在するが、洞調律より心拍数が低いため、これらはマスクされている。正常な洞調律より早い心拍数で、かつ洞結節以外の部位から出現する場合を異常自動能と考える。 |
| 撃発活動 | 心筋の再分極過程で、異常興奮(脱分極)が発生するもの。その発生に必ず活動電位が必要とされる異常電気活動である。細胞内のCa電流と関連性があり、ジギタリス中毒時での発生が知られている。 |
コラム2
| カテーテルアブレーションの原理 | 高周波通電により、カテーテル電極周囲の心筋組織に、ジュール熱が発生し、組織を焼灼する。先端の温度は40~80度に達し、3~5mm程度の焼灼が可能である。カテーテルの先端の温度により、出力をコントロールし、安全に焼灼できるようになっている。 |
|---|
コラム3
| 心房細動アブレーションの適応は? | 心房細動に対するアブレーションの適応は、1) 自覚症状を伴い、少なくとも1種類のⅠ群ないしⅢ群抗不整脈薬が無効である心房細動、2) 心房細動により、症状を伴う心不全ないし左心機能低下患者様である。 発作性心房細動及び持続期間が1年以内の持続性心房細動については、その治療成績が確立されてきており、治療経験のある施設においては、適応を考慮してよいと考えられる。一方持続期間が1年以上の永続性心房細動については、その治療成績が必ずしも満足いくものでない場合もあり、現時点ではその適応は慎重に考慮する。 |
|---|
last updated : 2021/10/01
