循環動態制御部
研究活動の概要
循環動態制御部の研究基本理念は、統合的な枠組みによる循環器系の生理的・病態生理的な機能の解明である。生体システムの統合された複雑な状態での重要な特性の解明をめざして、以下の方針で研究を構築している。循環動態制御部の研究分野の2つの柱は、「循環器系そのものの力学特性の解明」と「循環調節特性の解明」であり、両分野について基礎研究、応用研究および臨床に資する医療機器としての実用化の各階層にわたる研究を展開している(図)。特に、その結果としての最終目標として急性および慢性心不全の診断・治療の革新をめざした研究に焦点を当てている。さらに心不全の主たる死因である致死性不整脈の克服をめざし、基盤技術として心臓シミュレータを開発している。
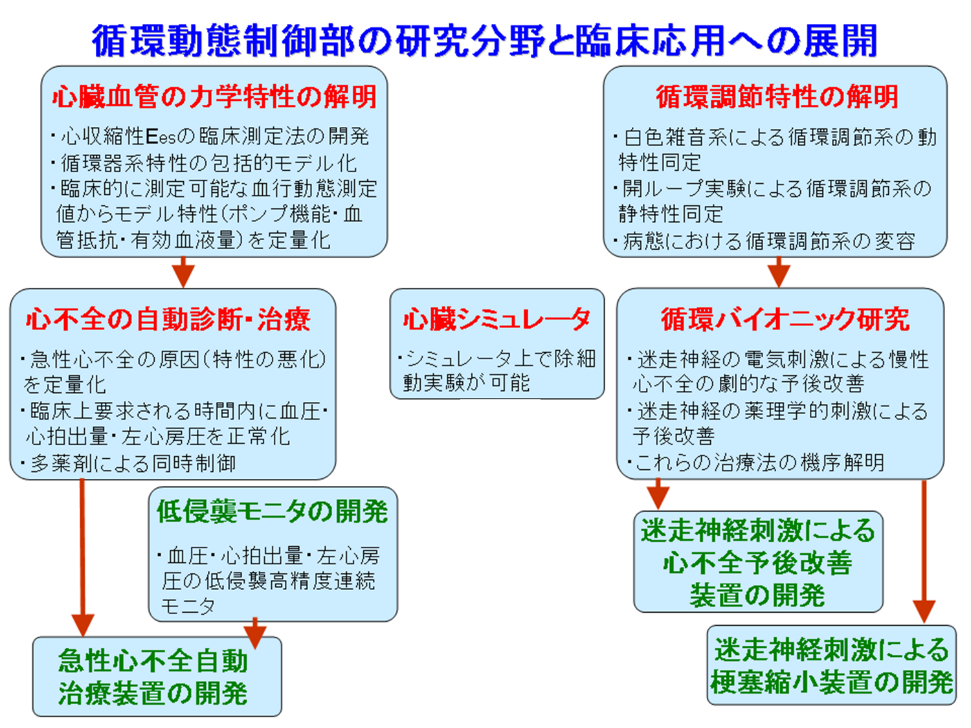
本年度、特に注力した研究分野は、下記の4つである。
- 包括的な循環器系(心臓・血管)特性解析(心不全の自動診断・治療)に関する研究
(図では「低侵襲モニタの開発」、「急性心不全自動治療装置の開発」) - 慢性心不全治療のための循環系の神経性・体液性の制御の基礎研究
(図では「循環調節特性の解明」) - 循環バイオニック医学:循環系の制御機構への介入による心不全治療の開発
(図では「循環バイオニック研究」) - 循環器疾患の克服に貢献する新しい医療機器の開発
(図では「迷走神経刺激による梗塞縮小装置の開発」)
以下に各項目について、その意義を記し、次項に本年度の成果の概要を列挙する。
- 包括的な循環器系(心臓・血管)特性解析(心不全の自動診断・治療)に関する研究:
心不全などの循環管理では心臓・血管の特性を定量的に把握する必要があり、これが臨床的に可能となれば、急性心不全の自動診断・自動治療が可能となる。これまでに開発した自動治療システムを心機能の保護の観点から改良する研究やβ遮断薬の安全最大投与に応用する研究を行っている。また、無侵襲的に血行動態をモニターできるシステムや低カフ圧で血圧を推定できる24時間自由行動下血圧計の開発を行っている。心臓特性の解析については、単心室症における機械的非同期の新しい評価法の確立などを行っている。 - 慢性心不全治療のための循環系の神経性・体液性の制御の基礎研究:
循環器疾患では心臓や血管系自体の異常に加え、これらの恒常性を維持する制御機構にも破綻をきたしている。このような病態を理解するために、循環制御系がどのような原理で心臓や血管系を制御しているのかを解明する研究を行っている。循環器疾患の新しい診断・治療法の開発に資するため、選択的徐脈薬が循環調節機構に及ぼす影響や、腎除神経が圧利尿に及ぼす影響の解析を行っている。また、虚血後の血管再生メカニズムの解明について、微小血管再生能を持つ細胞群の同定・解析を行っている。 - 循環バイオニック医学:循環系の制御機構への介入による心不全治療の開発:
生体の循環調節機構に外部より介入することにより、生体自身の調節を超える制御が可能であり、各種循環器疾患の予後を改善できることが明らかとなった。この原理(循環バイオニック医学)をもとにした治療法の開発を推進している。特に、迷走神経の電気刺激や薬物による刺激により重症慢性心不全の予後が改善することが明らかになったが、その機序解明、心筋梗塞縮小に関する研究を行っている。また、自動制御による飲水量調節・薬物投与量調節による新しい心不全治療の研究を行っている。 - 循環器疾患の克服に貢献する新しい医療機器の開発:
新規医療機器の開発に関して、心筋梗塞後の心不全発症を予防するカテーテル型治療装置の開発に取り組んでいる。
2019年の主な研究成果
- 包括的な循環器系(心臓・血管)特性解析(心不全の自動診断・治療)に関する研究:
血行動態を反映するパラメーターとして、多様な血行動態下で実効的脈波反射伝搬距離の包括的な解析を行った。ストレスフリー24時間自由行動下血圧計(ABPM)の開発に関して、低カフ圧のみで血圧の推定が可能な低カフ圧血圧モニターシステムの開発を継続した。低侵襲血行動態モニターの開発に関して、経食道心臓エコーを用いた心拍出量モニターの開発、呼気終末期陽圧変化による心血管パラメーターの推定を行った。急性心不全時の血行動態管理について、急性心不全時に循環破綻を回避し安全にβ遮断薬を投与する自動循環管理システムの開発、循環平衡モデルを用いた陽圧換気における血行動態予測を行った。単心室症における血行動態の評価について、単心室症における機械的非同期の評価法確立、心室内機械的非同期のモデル化の研究を行った。 - 慢性心不全治療のための循環系の神経性・体液性の制御の基礎研究:
慢性心不全の薬物治療に関して、選択的徐脈薬イバブラジンが迷走神経性心拍数調節に及ぼす影響、動脈圧反射を介する動的な血圧調節に及ぼす影響の研究を行った。中枢を介する循環制御について、迷走神経性心拍数調節における中枢経路の動特性の推定、中枢性降圧薬リルメニジンが動脈圧反射に及ぼす影響の平衡線図解析を行った。腎臓を標的としたデバイス治療に関して、腎除神経が圧利尿に及ぼす影響の研究を行った。虚血後の血管再生に関して、虚血骨格筋における微小血管再生能を持つ細胞群の同定、マクロファージ由来エクソソームの虚血骨格筋における組織保護作用の研究を継続した。 - 循環バイオニック医学:循環系の制御機構への介入による心不全治療の開発:
循環系の制御機構への介入による心不全治療に関して、迷走神経の電気刺激による生体内在性再生能力の賦活化を利用した新規心血管再生治療法の開発を継続した。迷走神経刺激治療のメカニズムの解明について、ドネペジル投与による心筋梗塞後重症心不全ラットにおける心臓保護作用の中枢機序の解明の研究を実施した。虚血再潅流モデルにおける薬物治療について、再潅流後心筋梗塞縮小薬の研究開発を行った。他疾患を合併した循環器疾患の制御系への介入に関して、ドネペジル長期投与による肥満性高血圧を合併した重症心不全ラットにおける心臓リモデリングの抑制作用及び心機能改善作用の研究を実施した。また、虚血性心不全モデルにおける飲水行動制御と薬理的迷走神経刺激の併用治療効果の検討を継続した。末梢における交感神経と迷走神経の相互作用について、交感神経刺激が迷走神経による心臓アセチルコリン放出に与える影響を明らかにした。 - 循環器疾患の克服に貢献する新しい医療機器の開発:
新しい治療機器の開発に関して、心筋梗塞後の心不全発症を予防するカテーテル型治療装置の開発を継続して実施した。
研究業績
- Ohuchi H, Negishi J, Hayama Y, Miike H, Suzuki D, Nakajima K, Konagai N, Iwasa T, Sakaguchi H, Kurosaki K, Nakai M. Abnormal glucose metabolism in patients with Fontan circulation: Unique characteristics and associations with Fontan pathophysiology. American Heart Journal. 216, 125-135, 2019.
- Chinen D, Nagai T, Uemura K, Aikawa Y, Motokawa T, Asaumi Y, Ogo T, Kanzaki H, Noguchi T, Anzai T, Shimizu W, Ogawa H, Sugimachi M, Yasuda S. Clinical Usefulness of an Echo-Doppler Model in Predicting Elevated Pulmonary Capillary Wedge Pressure in Patients With Heart Failure. American Journal of Cardiology. 123, 1464-1469, 2019.
- Kamada K, Saku K, Tohyama T, Kawada T, Mannoji H, Abe K, Nishikawa T, Sunagawa G, Kishi T, Sunagawa K, Tsutsui H. Diabetes mellitus attenuates the pressure response against hypotensive stress by impairing the sympathetic regulation of the baroreflex afferent arc. American Journal of Physiology-Heart and Circulatory Physiology. 316, H35-H44, 2019.
- Kawada T, Yamamoto H, Uemura K, Hayama Y, Nishikawa T, Sugimachi M. Intravenous ivabradine augments the dynamic heart rate response to moderate vagal nerve stimulation in anesthetized rats. American Journal of Physiology-Heart and Circulatory Physiology. 317, H597-H606, 2019.
- Kawada T, Akiyama T, Sonobe T, Shimizu S, Hayama Y, Pearson JT, Shishido T, Sugimachi M. Central activation of cardiac vagal nerve by α2-adrenergic stimulation is impaired in streptozotocin-induced type 2 diabetic rats. Autonomic Neuroscience-Basic & Clinical. 216, 39-45, 2019.
- Kawada T, Sonobe T, Hayama Y, Nishikawa T, Miyamoto T, Akiyama T, Pearson JT, Sugimachi M. Accentuated antagonism of vagal heart rate control and less potent prejunctional inhibition of vagal acetylcholine release during sympathetic nerve stimulation in the rat. Autonomic Neuroscience-Basic & Clinical. 218, 25-30, 2019.
- Asanuma H, Chung H, Ito S, Min KD, Ihara M, Takahama H, Funayama M, Imazu M, Fukuda H, Ogai A, Asano Y, Minamino T, Takashima S, Morita T, Sugimachi M, Asakura M, Kitakaze M. AST-120, an Adsorbent of Uremic Toxins, Improves the Pathophysiology of Heart Failure in Conscious Dogs. Cardiovascular Drugs and Therapy. 33, 277-286, 2019.
- Nagayama T, Nagase S, Kamakura T, Wada M, Ishibashi K, Inoue YY, Miyamoto K, Noda T, Aiba T, Takaki H, Sugimachi M, Shimizu W, Noguchi T, Yasuda S, Kamakura S, Kusano K. Clinical and Electrocardiographic Differences in Brugada Syndrome With Spontaneous or Drug-Induced Type 1 Electrocardiogram. Circulation Journal. 83, 532-539, 2019.
- Miyazaki A, Negishi J, Hayama Y, Baba S, Matsumura Y, Shima Y, Tsuda E, Sakaguchi H, Hoashi T, Kagisaki K, Noda T, Doi H, Ichikawa H, Ohuchi H. Evaluating the response to cardiac resynchronization therapy performed with a new ventricular morphology-based strategy for congenital heart disease. Heart and Vessels. 34, 1340-1350, 2019.
- Uemura K, Kawada T, Sugimachi M. A Novel Minimally Occlusive Cuff Method Utilizing Ultrasound Vascular Imaging for Stress-Free Blood Pressure Measurement A-Proof-of-Concept Study. IEEE Transactions on Biomedical Engineering. 66, 934-945, 2019.
- Yamamoto H, Kawada T, Shimizu S, Hayama Y, Shishido T, Iwanaga Y, Fukuda K, Miyazaki S, Sugimachi M. Acute effects of intravenous carvedilol versus metoprolol on baroreflex-mediated sympathetic circulatory regulation in rats. International Journal of Cardiology. 285, 65-71, 2019.
- Kawada T, Yamazaki T, Akiyama T, Hayama Y, Sugimachi M. Mild Hypothermia Is Ineffective to Protect Against Myocardial Injury Induced by Chemical Anoxia or Forced Calcium Overload. Journal of Cardiovascular Pharmacology. 73, 100-104, 2019.
- Kawada T, Shimizu S, Uemura K, Hayama Y, Yamamoto H, Shishido T, Nishikawa T, Sugimachi M. Ivabradine preserves dynamic sympathetic control of heart rate despite inducing significant bradycardia in rats. Journal of Physiological Sciences. 69, 211-222, 2019.
- Li MH, Zheng C, Kawada T, Inagaki M, Uemura K, Sugimachi M. Chronic vagal nerve stimulation exerts additional beneficial effects on the beta-blocker-treated failing heart. Journal of Physiological Sciences. 69, 295-303, 2019.
- Kamiya A, Hayama Y, Kato S, Shimomura A, Shimomura T, Irie K, Kaneko R, Yanagawa Y, Kobayashi K, Ochiya T. Genetic manipulation of autonomic nerve fiber innervation and activity and its effect on breast cancer progression. Nature Neuroscience. 22, 1289-1305, 2019.
- Uemura K, Kawada T, Zheng C, Li MH, Sugimachi M. Low-Dose Landiolol Reduces Heart Rate and Cardiac Oxygen Consumption Without Compromising Initial Hemodynamic Resuscitation in a Canine Model of Endotoxin Shock. Shock. 52, 102-110, 2019.
- Nakahara H, Kawada T, Ueda SY, Kawai E, Yamamoto H, Sugimachi M, Miyamoto T. Acupoint dependence of depressor and bradycardic responses elicited by manual acupuncture stimulation in humans. Journal of Physiological Sciences. 69, 1077-1084, 2019.