細胞生物学部
研究内容
血管新生と維持機構の分子メカニズムの解明
血管新生と維持機構の分子メカニズムの解明
(1) Vascular endothelial growth factor(VEGF) と受容体VEGFRによる血管新生調節機構の理解
これまで血管新生でまず伸長する血管枝の先導端内皮細胞はVEGFの刺激を受けること(VEGFRの活性化)により増殖・運動が誘導される。一方、先導端細胞に続くフォロワー細胞はVEGFRの活性化が抑制されることが報告されてきた。この先導細胞とフォロワー細胞間には、先導細胞に発現するDelta-like 4(Dll4:VEGFR活性化により発現が増加する)がフォロワー細胞のNotch受容体を刺激することによりVEGFRの転写が抑制されると考えられていた。しかし、我々の研究では、血管新生時の内皮細胞のCa2+イメージングにより先導細胞だけでなくフォロワー細胞でもVEGFRが活性化していることが明らかになった。
Yokota Y, Nakajima H, Wakayama Y, Muto A, Kawakami K, Fukuhara S, Mochizuki N. Endothelial Ca(2+) oscillations reflect VEGFR signaling-regulated angiogenic capacity in vivo. Elife doi: 10.7554/eLife.08817.
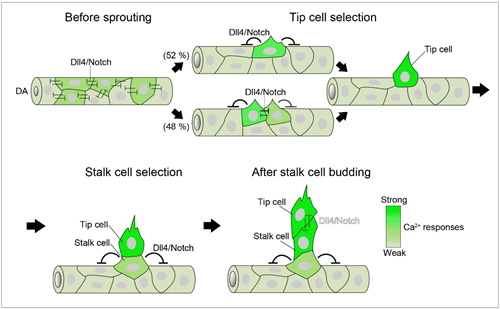
大動脈からの分枝血管内皮細胞のCa2+ イメージング:緑色蛍光がCa2+の増加を示している
(2) Angiopoietin-Tie 受容体系による血管形成・血球形成機構
Angiopoietin(Ang)ファミリー分子は、Ang1, Ang2, Ang3とAng4からなり、チロシンキナーゼ受容体のTie1, Tie2 を活性化することにより血管形成や血球形成を調節すると報告されている。なかでもAng1-Tie2受容体系が血管新生には必須であることがそれぞれの遺伝子破壊マウスの解析からも明らかになっている。Ang1 は血管内皮細胞を管腔外から裏打ちする周細胞から分泌され血管内皮細胞に発現するTie2を活性化することにより血管内皮細胞の維持に重要である。この制御は一方向性ではなく、血管内皮細胞から分泌されるplatelet-derived growth factor-B (PDGF-B)が周細胞に発現するPDGFRβを活性化することにより周細胞を維持していることから、血管内皮細胞―周細胞の双方向性調節が血管の維持には大切である。
われわれは、血管新生過程でどのように周細胞(PDGFRβ 陽性細胞)が発現して血管構築に関わるかをイメージングによって明らかにした。
Ando K, Fukuhara S, Izumi N, Nakajima H, Fukui H, Kelsh RN, Mochizuki N. Clarification of mural cell coverage of vascular endothelial cells by live imaging of zebrafish. Development. 2016 Mar 7. pii: dev.132654.
脳内で血管内皮細胞(赤)だけからなる血管網に、周細胞(緑)が接着しながら移動して血管が成熟していく。
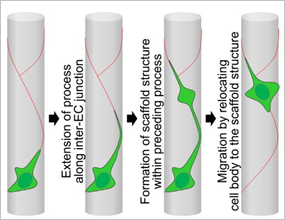
緑がPDGFRb 陽性の周細胞で血管内皮細胞間接着がピンク
緑色の周細胞が血管内皮細胞間接部位にfoot processを伸長させて移動する。
このほかにもゼブラフィッシュではhemogenic endothelium(発生段階の大動脈の腹側の血管内腔の細胞群)から内皮細胞と血液幹細胞が分化することが報告されている。Ang1 の遺伝子破壊あるいは、Tie2の遺伝子破壊ゼブラフィッシュで血管内皮細胞あるいは血液幹細胞の運命決定に障害があるかどうかを調べることによりAng1-Tie2の新たな機能解明につなげていく計画である。
最終更新日:2024年03月05日
