脳血管内科・脳神経内科
さらに詳しく
脳神経内科(脳内Bグループ)

国立循環器病研究センター脳神経内科では、猪原匡史部長を主任研究者として、①脳血管障害の病態解明、②診断技術の向上、③治療成績の向上、④後遺症の予防を目指し、基礎・臨床の両面から様々な研究活動に取り組んでおります。特に治療研究に関しては、脳血管障害に関係する細胞実験(iPS細胞)、げっ歯類モデル、非人類霊長類モデル、臨床研究、医師主導治験というすべてのステージの研究に取り組んでいる、世界でも非常に珍しい研究グループです。国立循環器病研究センター内では、臨床研究に関しては脳血管内科と、基礎研究では研究所と深く連携し、脳血管障害の制圧を目指し、日々の研究に取り組んでおります。
脳卒中およびその関連疾患の臨床または研究に従事したいと希望される方は、お気軽に当センターへ見学にお越しください。
E-mail: ihara(at)ncvc.go.jp(脳神経内科・猪原:(at)を@に変更ください)までご連絡をお待ちしています。
脳神経内科の活動は、フェイスブックでも公開しております(@neurology.ncvc)
| 氏名 | 職名 | 専門医資格 | 専門領域 |
|---|---|---|---|
| 猪原 匡史 | 部長 | 日本神経学会専門医・指導医 日本内科学会認定総合内科専門医・指導医 日本脳卒中学会専門医・指導医 日本認知症学会専門医・指導医 米国内科学会上級会員(FACP) 米国心臓協会フェロー(FAHA) | 脳血管障害と認知症の 臨床および研究 |
| 服部 頼都 | 医長 | 日本神経学会専門医・指導医 日本脳卒中学会専門医・指導医 日本内科学会総合内科専門医・指導医 日本認知症学会専門医・指導医 日本老年医学会老年病専門医・指導医 | 脳卒中と認知症(血管性認知障害,アルツハイマー病)の臨床と研究 |
| 田中 智貴 | 医長 | 日本内科学会総合内科専門医・指導医 | 神経内科 脳卒中 |
| 齊藤 聡 | 医師 | 日本神経学会専門医・指導医 日本脳卒中学会専門医・指導医 日本認知症学会専門医・指導医 | 脳卒中 |
| 福間 一樹 | 医師 | 日本内科学会認定医 日本神経学会専門医 日本脳卒中学会専門医 日本てんかん学会専門医 日本脳神経血管内治療学会専門医 日本脳神経超音波学会脳神経超音波検査士 | 脳血管障害 神経内科学 てんかん学 |
| 吉本 武史 | 医師 | 日本内科学会認定医 日本神経学会専門医・指導医 日本脳卒中学会専門医・指導医 日本脳神経血管内治療学会専門医 日本脳神経超音波学会脳神経超音波検査士 | 脳血管障害 |
| 阿部 宗一郎 | 医師 | 日本内科学会認定医 | 脳血管障害 |
| 石山 浩之 | 医師 | 日本内科学会認定医 | |
| 専門修練医:鴨川徳彦 山口枝里子 山城貴之 野田浩太郎 村田博朗 碓井遼 レジデント:江頭柊平 黒田健仁 柿野圭紀 加藤雅彦 中澤晋作 乾涼磨 塩見悠真 専攻医:稲垣泰申 滝川浩平 貴田浩之 | |||
主な研究活動について
1.もやもや病感受性遺伝子RNF213 p.R4810K多型と脳卒中との関連
若年者の脳血管障害は、高齢者と異なり発症機序が明らかではない場合が多く、適切な治療やリスクの評価が難しい疾患です。これまでにも様々な形で遺伝的素因の検討がされてきましたが、いまだ完全には解明されていません。我々のグループは、もやもや病感受性遺伝子であるRNF213 p.R4810K多型に注目し、この遺伝子多型が日本を含むアジア地域においては、もやもや病と診断されていない若年性脳梗塞患者においても危険因子となっている可能性があると考え、日本医療研究開発機構(AMED)循環器疾患・糖尿病等生活習慣病対策実用化研究事業から支援を受け、当センター脳血管内科、脳神経外科、バイオバンク部門、そして株式会社島津製作所などと協力して現在精力的に研究を進めています。
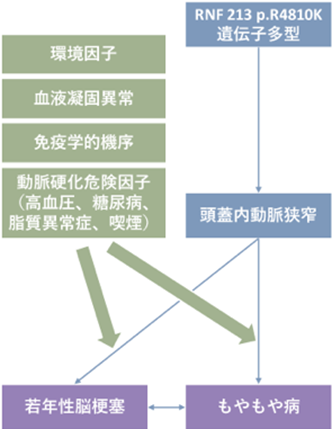
図. 若年性脳梗塞患者におけるRNF213遺伝子多型の関連
p.R4810K多型は,家族性もやもや病患者の約90%でみとめられるのと同時に、一般人口においても2-3%の未発症キャリアが存在することが明らかになっています。また、診断基準ではもやもや病と診断されない日本人頭蓋内動脈狭窄患者においても22%と高頻度に本多型が認められることから、もやもや病以外でも脳血管障害の感受性遺伝子となりうる可能性が示唆されています。実際,私たちの検討においても、RNF213遺伝子のp.R4810K多型が日本人の脳梗塞の強力な感受性遺伝子であることが示されています。
しかしながら、RNF213 p.R4810K多型を保有していても実際に脳梗塞を発症するのは50~100人に1人と見積もられています。したがって、今後はその発症を規定している環境要因やほかの遺伝要因の探索が望まれています。
関連論文:
- Okazaki S, Morimoto T, Kamatani Y, et al. Moyamoya Disease Susceptibility Variant RNF213 p.R4810K Increases the Risk of Ischemic Stroke Attributable to Large-Artery Atherosclerosis. Circulation. 2019;139(2):295-298.
- Kamimura T, Okazaki S, Morimoto T, et al. Prevalence of RNF213 p.R4810K Variant in Early-Onset Stroke With Intracranial Arterial Stenosis. Stroke. 2019;50(6):1561–1563.
- Hosoki S, Yoshimoto T, Ihara M. A case of hemichorea in RNF213-related vasculopathy. BMC Neurol. 2021;21:32.
- Eto F, Yoshimoto T, Okazaki S, et al. RNF213 p.R4810K (c.14429G > A) Variant Determines Anatomical Variations of the Circle of Willis in Cerebrovascular Disease. Front Aging Neurosci. 2021;13:681743.
- Ohara M, Yoshimoto T, Okazaki S, et al. RNF213 p.R4810K Variant Carriers with Intracranial Arterial Stenosis Have a Low Atherosclerotic J Atheroscler Thromb. (in press)
- Yamaguchi E, Yoshimoto T, Ogura S, et al. Association of the RNF213 p.R4810K Variant With the Outer Diameter of Cervical Arteries in Patients With Ischemic Stroke. Stroke: Vascular and Interventional Neurology. 2022;0:e000298
- Yoshimoto T, Tanaka K, Koge J, et al. Impact of the RNF213 p.R4810K variant on endovascular therapy for large vessel occlusion stroke. Stroke: Vascular and Interventional Neurology. (in press)
2.CADASILの病態解明と新規治療法の開発 (アドレノメデュリンの医師主導治験)
CADASIL(皮質下梗塞と白質脳症を伴う常染色体優性脳動脈症)(指定難病124)は血管性認知症やラクナ梗塞を呈する代表的な遺伝性脳小血管病です。NOTCH3遺伝子の変異により常染色体優性遺伝形式で発症し、大脳白質病変を特徴とします。CADASILの病態についての詳細は、CADASIL研究班のホームページをご参照下さい。私たちは、CADASILの動物モデルとCADASILの患者さんから樹立したiPS細胞を用いて遺伝性血管性認知症の病態を解明する研究を行っています。
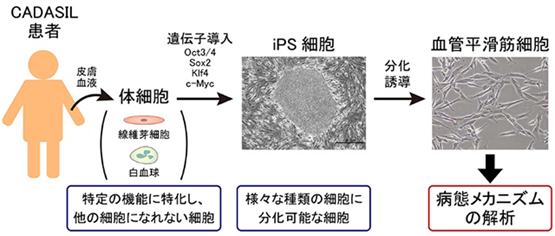
2021年11月からCADASIL患者にアドレノメデュリンを投与する医師主導治験を開始しました。アドレノメデュリンは、52個のアミノ酸からなるペプチドホルモンです。循環器系臓器で広く作られ、血管を拡張させたり、血管新生を促したりと、多彩な作用が知られています。アドレノメデュリンは脳虚血や低酸素等に反応して生体内で産生されるため、アドレノメデュリンは脳虚血に対する生体防御反応をつかさどると考えられています。治療薬としてのアドレノメデュリンの有効性は各種の動物実験で示されてきました。CADASILの中核病変である大脳白質病変を再現する血管性認知症モデル動物において、アドレノメデュリンが血管新生を誘導し、炎症を抑制して、大脳白質病変や認知機能を改善することが示されています。更に細胞培養実験では、アドレノメデュリンが低酸素下で抑制される乏突起膠細胞前駆細胞の分化を促進することが確認されており、これは大脳白質の再生作用と考えられています。以上から、CADASILに対して、アドレノメデュリンを投与する臨床試験が待ち望まれていました。
臨床応用に向け、アドレノメデュリンの安全性が問題となります。しかし、そもそもアドレノメデュリンはヒトの体内に存在する生理活性物質であるという点が強みと言えます。すでに炎症性腸疾患、うっ血性心不全、急性心筋梗塞、陳旧性脳梗塞の患者でアドレノメデュリンが投与された臨床研究の報告があり、いずれも大きな有害事象は生じていません。また、国立循環器病研究センターでは2019年から急性期脳梗塞患者を対象としたアドレノメデュリンの医師主導治験を行っております。そして今回、日本医療研究開発機構(AMED)難治性疾患実用化研究事業の支援を受け、CADASIL患者を対象としたアドレノメデュリンの有効性と安全性の評価を目的とした医師主導治験(AMCAD試験)を企画することとなりました。

https://forms.office.com/r/fZneReNc8c
(CADASIL患者様もしくはそのご家族様限定)

関連論文:
- Yamamoto Y, Ihara M. Disruption of transforming growth factor-beta superfamily signaling: A shared mechanism underlying hereditary cerebral small vessel disease. Neurochem Int. 2017;107:211-218.
- Yamamoto Y, Kojima K, Taura D, et al. Human iPS cell-derived mural cells as an in vitro model of hereditary cerebral small vessel disease. Mol Brain. 2020;13:38.
- Yamamoto Y, Hase Y, Ihara M, et al. Neuronal densities and vascular pathology in the hippocampal formation in CADASIL. Neurobiol Aging. 2021;97:33-40.
3.脳卒中後てんかんの診断、予防、治療法の策定
脳卒中後てんかんは脳卒中の後遺症として重要であり、約10%の脳卒中生存者に合併する疾患とされており、高齢者てんかんの原因でも3分の1以上を占める重要な疾患ですが、世界においても未だエビデンスの乏しい分野であり、診断、治療においての研究が望まれています。
我々は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業の支援を受け、2014年11月~2019年9月に脳卒中後てんかんの多施設前向き観察研究を行い、旧世代抗てんかん薬(2006年以前に本邦にて上市)と比較して、新世代抗てんかん薬が発作再発防止、服薬継続率において、実臨床下で高い効果を示していることを報告しました。
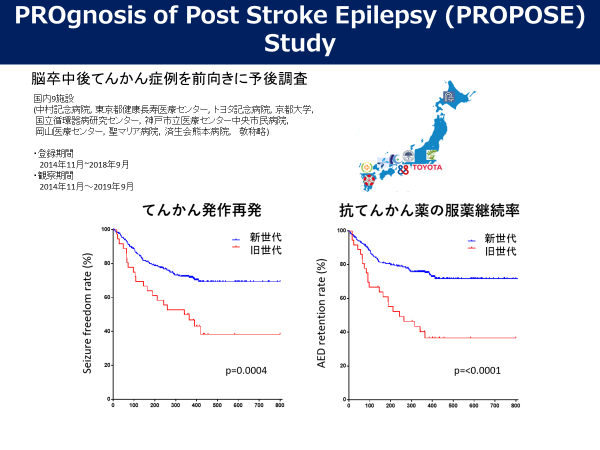
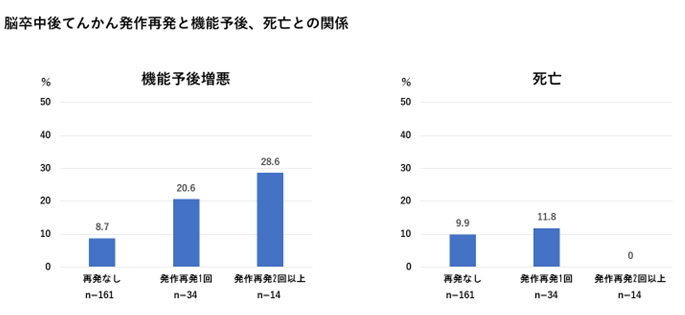
さらに、副次的解析において、脳卒中後てんかん発作の再発による機能予後悪化への影響や、ECD-SPECTを用いた過灌流検出法の開発と病態研究、症候(非運動起始発作・発作後麻痺・発作後遺症)の特徴に関する調査などを行い、報告しています。
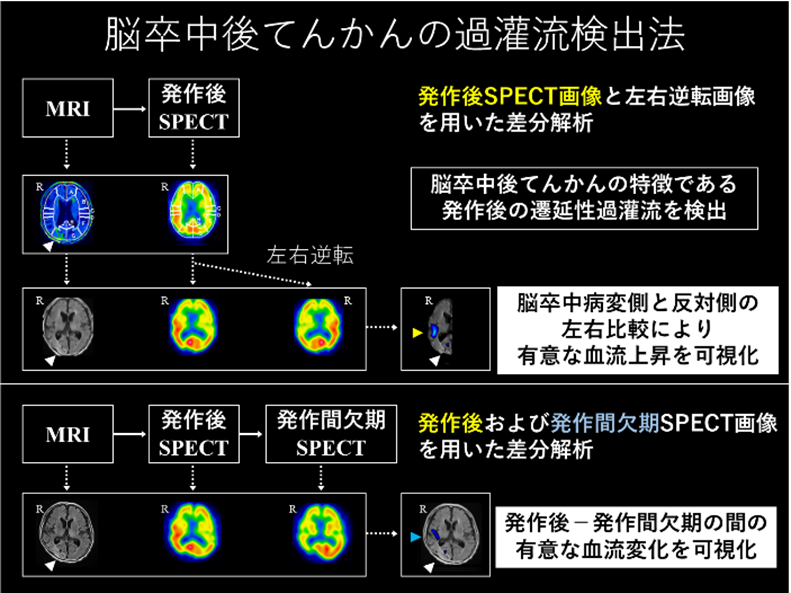
また、脳卒中後てんかん症例の脳波所見について脳波所見読影会(毎週金曜日)を検査技師の先生方と開催し、また、月に1回、吹田市民病院等のてんかん専門医の先生方との勉強会を行い、脳波読影のスキルアップを図っています。さらに、脳血流画像(脳血流SPECT、MRI(ASL)法、CT灌流画像)、脳波持続モニタリングシステム等のマルチモダルティで診療を行い、さらなる病態解明を目指しています。
関連論文:
- Tanaka T, Fukuma K, Abe S, et al. Antiseizure medications for post‐stroke epilepsy: A real‐world prospective cohort study. Brain and Behavior. 2021;11:e2330.
- Fukuma K, Kajimoto K, Tanaka T, et al. Visualizing prolonged hyperperfusion in post-stroke epilepsy using postictal subtraction SPECT. J Cereb Blood Flow Metab.2021;41:146-156.
- Yoshimura H, Tanaka T, Fukuma K, et al. Impact of Seizure Recurrence on 1-Year Functional Outcome and Mortality in Patients With Poststroke Epilepsy. Neurology. (in press)
- Fukuma K, Ikeda S, Tanaka T, et al. Clinical and imaging features of nonmotor onset seizure in poststroke epilepsy. Epilepsia. (in press)
- Fukuma K, Tanaka T, Takaya S, et al. Developing an asymmetry method for detecting postictal hyperperfusion in poststroke epilepsy. Front.Neuvol. (in press)
4.脳血管障害の診断の向上を目指す研究
脳神経内科では、脳血管障害の診断精度の向上、新たな画像診断法の開発、後遺症の軽減や抑制を目指し、様々な研究に取り組んでおります。
(1)超音波を用いた脳血管障害の新たな診断・治療法の開発
① 脳血管障害における頚動脈不安定プラークの超音波診断
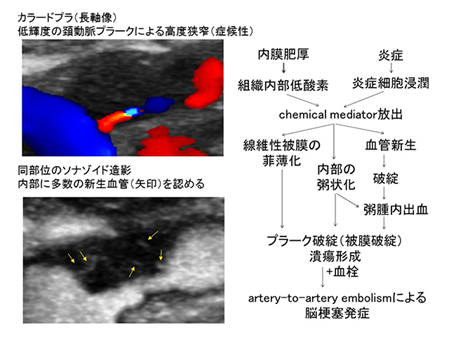
動脈硬化による粥状硬化性病変(プラーク)はその進展により血管狭窄を引き起こすだけでなく、破綻によって粥腫や血栓が塞栓となって脳梗塞を引き起こすため、このようなリスクの高いプラークは不安定プラークとよばれています。
頚動脈エコー検査でプラークが安定したものなのか、不安定で脳梗塞を起こしそうなのかを調べることができれば脳梗塞発症予防に大きく貢献できると考え、我々は超音波造影剤を用いてプラークの不安定性を評価する研究を行っています。プラーク内部の新生血管を描出し、新生血管の多いプラークで脳梗塞発症例が多いことや、通常のエコー検査ではわからないようなごく小さな潰瘍を早期にみつけられることもわかり、さらにプラークの質的診断向上を目指して研究を行っています。
超音波造影剤は現在日本で保険適応となっているものがなく、代替とするために各超音波機器で非造影での新生血管の検出ができないか検討する研究も行っています。

関連論文:
- Saito K, Nagatsuka K, Ishibashi-Ueda H, et al. Contrast-Enhanced Ultrasound for the Evaluation of Neovascularization in Atherosclerotic Carotid Artery Plaques. Stroke. 2014;45:3073-3075.
- Motoyama R, Saito K, Tonomura S, et al. Utility of Complementary Magnetic Resonance Plaque Imagingand Contrast-Enhanced Ultrasound to Detect Carotid Vulnerable Plaques. J Am Heart Assoc. 2019;8:e011302.
②Bow-Hunter症候群の超音波診断
超音波検査は、術者によって検査結果が大きく変動しうる難しい検査ですが、非侵襲的で非常に多くの情報を得ることができるため、脳神経内科では積極的に様々な臨床研究を展開しております。首を動かすことで血管が圧迫されて若年性に脳梗塞を起こす症候群としてBow-Hunter症候群という病気が知られており、この症候群を見逃さないようにするための超音波診断のアルゴリズムを国際誌上で発表しました。
関連論文:
- Kimihira L, Yoshimoto T, Saito S, et al. Various head rotations for ultrasonographic diagnosis of bilateral bow hunter’s syndrome. Acta Neurologica Belgica. 2020;120(4):1003-1005.
- Kimihira L, Yoshimoto T, Ihara M. New Diagnostic Algorithm for Detection of Covert Bow Hunter’s Syndrome. New Diagnostic Algorithm for Detection of Covert Bow Hunter’s Syndrome. Int J Med Sci. 2021; 18(10):2162-2165.
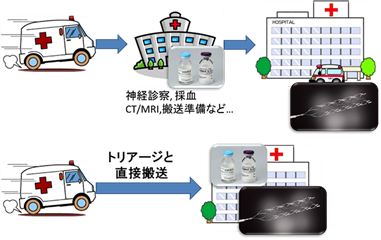
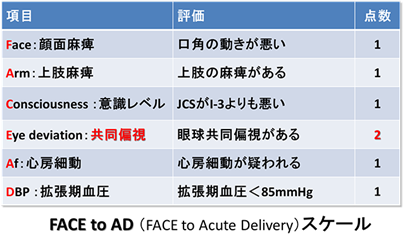
(2)脳主幹動脈閉塞を予測する病院前脳卒中スケールの開発
脳梗塞が発症してから血管内治療を開始するまでの時間を出来るだけ短縮するために、救急隊が簡便に脳主幹動脈閉塞による脳梗塞を見分けることが出来るFACE2-ADスケールという指標を作成しました。今後、脳卒中診療の現場で広く使用されていくことが期待されています。
関連論文:
- Okuno Y, Yamagami H, Kataoka H, et al. Field Assessment of Critical Stroke by Emergency Services for Acute Delivery to a Comprehensive Stroke Center: FACE2AD. Translational Stroke Research. 2020;11(4):664-670.
(3)脳卒中の予後予測研究
脳卒中急性期に電気生理学的手法や、特殊なMRI撮影方法を用いて患者さんの予後を予測できるアルゴリズムを開発する研究を行っています。その方法を将来の脳卒中の臨床研究のデザインに組み込むことで、より質の高い臨床研究、治療開発研究を目指しています。
(4)脳卒中後合併症・後遺症の実態調査
脳卒中急性期から摂食嚥下障害、低栄養状態、サルコペニア・フレイルの早期診断を行う診療体制を構築し、データ解析を行っています。脳卒中後サルコペニアについては、千里リハビリテーション病院と共同で急性期から回復期にかけての縦断調査を行っています。
関連論文:
- Ikeda S, Washida K, Tanaka T, et al. A Nationwide Multi-Center Questionnaire Survey on the Real-World State and Issues Regarding Post-Stroke Complications in Japan. J Stroke Cerebrovasc Dis. 2021;30:105656.
5.脳卒中 (特に脳出血の病因研究)
大阪大学歯学研究科との共同研究で、う蝕原性細菌(通称、虫歯菌)が脳出血の強い危険因子となることが明らかになりました。高血圧の管理によって減少はしているものの、外国に比べて我が国に依然多いとされる脳出血の予防法開発につなげたいと考えています。
さらに我が国と同じく脳出血の頻度が多いアフリカ諸国(ケニア,ナイジェリア)や東南アジア諸国(インドネシア,シンガポール)との国際多施設共同研究も進めています。上述したRNF213血管症の発症にも感染症が関与する可能性があり、脳卒中の予防法の開発への応用研究を進めています。
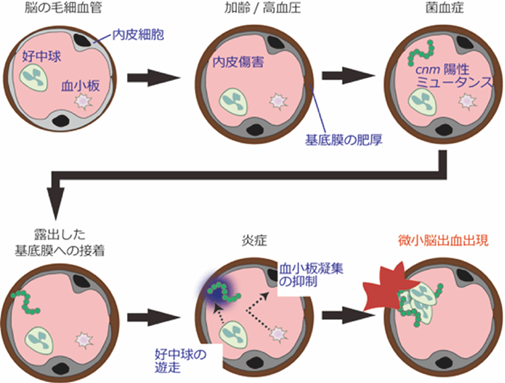
関連論文:
- Tonomura S, Ihara M, Kawano T, et al. Intracerebral hemorrhage and deep microbleeds associated with cnm-positive Streptococcus mutans; a hospital cohort study. Sci Rep 2016;6:20074.
- Ihara M, Yamamoto Y. Emerging Evidence for Pathogenesis of Sporadic Cerebral Small Vessel Disease. Stroke 2016;47:554-560.
- Tonomura S, Ihara M, Friedland RP. Microbiota in cerebrovascular disease: A key player and future therapeutic target. J Cereb Blood Flow Metab. 2020;40:1368-1380.
- Hosoki S, Saito S, Tonomura S, et al. Oral Carriage of Streptococcus mutans Harboring the cnm Gene Relates to an Increased Incidence of Cerebral Microbleeds. Stroke. 2020;51:3632-3639.
- Hosoki S, Hattori Y, Saito S, et al. Risk Assessment of Cnm-Positive Streptococcus mutans in Stroke Survivors (RAMESSES): Protocol for a Multicenter Prospective Cohort Study. Front.
Neurol 2022;13:816147.
その他の実績は、業績年報よりご覧ください。
最終更新日:2023年08月07日

