不整脈科
対象疾患・治療法
カテコラミン誘発性多形性心室頻拍
カテコラミン誘発性多形性心室頻拍
1)疾患概要
カテコラミン誘発多形性心室頻拍(Catecholaminergic Polymorphic Ventricular Tachycardia: CPVT)は比較的まれな疾患で、その頻度は10,000人に1人程度と言われているが正確な数は不明である1-3。通常10歳前後で運動や興奮時,カテコラミン投与などにより心室頻拍(VT)や心室細動(VF)を発症し、若年者の失神発作や突然死の原因として重要である4。無治療では10年生存率が60%程度と推定され2、極めて予後不良な疾患である。
CPVT患者の安静時心電図は明らかな異常所見はなく、心臓超音波検査、CT、MRIなども正常であり、無症状のCPVT患者を通常の臨床検査から診断することは極めて難しい。一方、器質的心疾患を認めず安静時心電図では異常所見のない40歳未満で、運動もしくはカテコラミン投与により他に原因が考えられない2方向性VT(図1)、多形性VT・期外収縮(PVC)が誘発される場合には、CPVTと比較的容易に診断可能である。またCPVT患者の60~70%に遺伝子異常が見つかり、CPVTは遺伝学的検査によっても診断可能である。
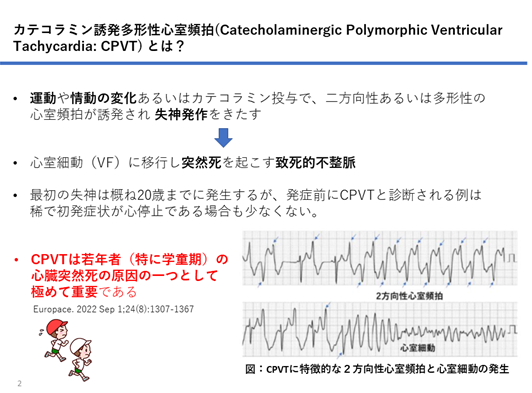
図1:カテコラミン誘発多形性心室頻拍の疾患概念
2)診断(検査、鑑別診断)
a. 臨床診断
CPVT患者の初発症状は失神発作であり、運動あるいは感情ストレスが誘因となる1, 2。学童期の運動やストレス時の意識消失発作の場合、CPVTを疑う必要がある。最初の失神は主に7~12歳ごろで少なくとも20歳までに発生することが多い5。初発が心停止の場合もあり,乳幼児突然死症候群や特発性心室細動の原因がCPVTであることもある。
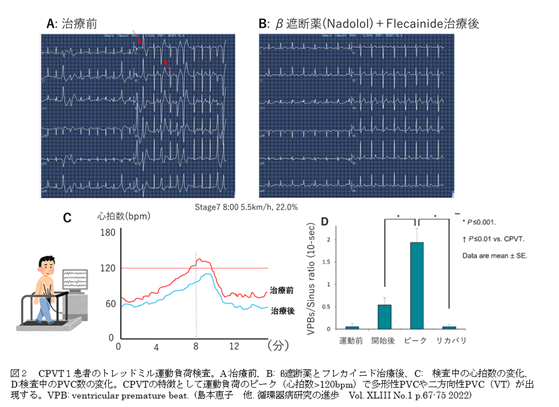
トレッドミルなどの運動負荷心電図は、CPVTを診断するうえで最も有力な検査法である(図2)3。運動により多形性VT,2方向性VT(1拍ごとにQRSの極性が180度変わり,VT波形間の連結期がほぼ一定の頻拍)が出現し、きわめて速いVT/VFが誘発されると失神や突然死を惹起する2。
一方、未発症(無症状)CPVTに対する臨床診断は容易ではない。2方向性VTはCPVTに特徴的で特異度は高いが,その出現率は必ずしも高くなく感度も50%程度と言われる。さらに軽症例ではPVCの単発あるいは2段脈しか認められないことがある3。アドレナリン(Epinephrine)負荷試験は,運動負荷試験を実施できない症例に有用と考えられるが、特異度は高いものの2方向性PVCやVTの誘発率は運動負荷よりさらに低い(28%)。ホルター心電図も日常生活や学校生活上での不整脈検出に有用であるが、実際の不整脈検出率は運動負荷検査よりも低い。なお心臓電気生理学的検査(EPS)は、CPVTの診断的価値は低く、心臓突然死のリスク評価としてEPSによるVT/VF誘発は禁忌である。
鑑別診断としては、失神発作の原因である「てんかん」、パニック発作なども臨床的に鑑別が必要である。特に「てんかん」と診断されていたが、実際には失神の原因はCPVTによる不整脈が原因であった例は多い。また同じ遺伝性不整脈のなかで先天性QT延長症候群(特にLQT1型)、Andersen-Tawil症候群(ATS)などは、運動中の失神発作や多形性PVC、2方向性VT/PVCなどCPVTと共通点が多く遺伝子検査による鑑別が重要である。
b. 遺伝学的検査
CPVTの60~70%に原因遺伝子が同定され、そのほとんどが心筋リアノジン受容体(RyR)の遺伝子RYR2 であり常染色体顕性遺伝形式である6。患者の病歴,家族歴,心電図所見などから臨床的にCPVT と診断あるいは疑われた患者に対して、診断確定のため遺伝学的検査が推奨(クラスI)される(ただし保険適用外)。また家族に対しては,当該患者(発端者)においてみつかった遺伝子異常の有無を検査することが推奨される。
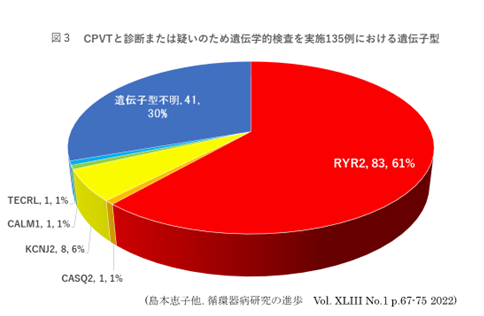
当センターでCPVTと診断または疑いのため、遺伝学的検査を実施した135例中83例(61%)にRYR2の病的あるいは病的の可能性のあるバリアントを認めた(図3)。しかしRYR2遺伝子はエクソンが105個の巨大な遺伝子であり、健常者にも多くのバリアントが報告されている。そのほとんどはCPVTとは無関係または関係性が不明なVUS(Variant of unknown significance)である。従ってRYR2にVUSが見つかっても、表現型あるいは家族整合性が不明瞭な場合には安易にCPVTと診断すべきではない。
RYR2の他にはCASQ2を始めCALM1, TECRL, TRDNなど複数の遺伝子を認めているがいずれも極めて稀で、通常CPVTの遺伝子検査としてはRYR2 (CPVT1)とCASQ2(CPVT2)が推奨される。なお、若年者の運動・ストレス時の失神発作の場合、LQT1やATSとの鑑別も重要である。臨床的にLQTSと診断または疑われたが遺伝子検査ではLQT関連遺伝子には疾患原因遺伝子を同定できない場合は、RYR2遺伝子も検査を考慮する。
以上からCPVTは運動誘発性の失神発作や2方向性VTなど典型的な臨床像を呈する場合は比較的容易に診断可能であるが、逆にそうでない患者・家族などの場合には積極的に疑って負荷心電図検査などを行わないと診断は容易とは言えない。そのため遺伝学的検査も診断確定や鑑別診断に非常に有用である。
3)治療
a. 生活指導
CPVTと診断された場合、原則として運動(特に競技スポーツ)は禁止すべきである。また日常生活でも、可能な範囲で精神的・肉体的ストレスは避けることが望ましい。ただしCPVTは運動のピーク時(心拍数≧110bpm)で心室不整脈が出現する場合が多く(図2)、逆に言えば十分な薬物治療により心拍数が110~120まで増加しない程度にコントロールされていれば、通常の日常生活程度で不整脈による失神発作や突然死を来す可能性は低い。
b. 薬物治療
CPVTと診断された場合、薬物治療としてはβ遮断薬(クラスI適応)、Flecainide(クラスIIa)の2つが有用である。一般的にはβ遮断薬が第一選択とされ、β遮断薬の中でもNadolol(商品名:ナディック)が推奨される。β遮断薬内服下でも不整脈抑制の効果不十分な場合にFlecainide(商品名:タンボコール)を追加投薬する。しかし、実際には多くの患者で両方の薬が必要となり、またβ遮断薬は徐脈や血圧低下、倦怠感など副作用のため十分な量を内服できない例も多く、Flecainideの役割が重要となっている。
c. 植込み型除細動器(ICD)
ICDは不整脈疾患における心臓突然死を予防するもっとも優れた機器であるが、ICDによる電気的除細動によって交感神経がさらに緊張状態となりCPVTを惹起しVFストーム化が懸念されている。しかし、VF蘇生後などハイリスク患者に薬物治療のみで絶対に安全とは言い切れない。現実的にはVF蘇生後患者では突然死の2次予防目的としてICD植込みが絶対適応(クラスI)とされる。問題は薬物治療下で失神発作を繰り返す場合であるが、最近発表された国際研究の結果からも、薬剤抵抗性のCPVTに対するICD植込みに肯定的な結果7と否定的な結果8が報告され結論は出ていない。若年者の場合、突然死予防効果とICD長期留置が及ぼすデメリット(感染、リード断線、静脈閉塞、精神的問題など)を総合的に考え適用を慎重に判断すべきである。
4)まとめ
CPVTは極めて稀な遺伝性不整脈疾患であるが、若年者とくに学童期の運動中の失神例では積極的に疑うべきで、早期診断と治療介入を行うことで予後改善が可能である。臨床的には運動負荷検査、さらに遺伝学的検査が非常に重要である。さらに家系内でRYR2遺伝子変異をもつ同胞(兄弟姉妹)の心イベント発生率は高く、両親、同胞への遺伝学的検査は患者本人のみならず、家族にとっても非常に有用である。
薬物治療として近年Flecainideの有効性が報告されたが、β遮断薬とどちらを第一選択とすべきかについては結論が出ていない。またICDについては、VF蘇生後などハイリスク患者においては、十分な薬物治療を行ったうえでそのメリットとデメリットを総合的に判断して適用を考慮すべきである。
参考文献
- Leenhardt A, et al. Circulation. 1995;91:1512-9.
- Sumitomo N, et al. Heart. 2003;89:66-70.
- Lieve KV, et al. Circ J. 2016;80:1285-91.
- Roston TM, et al Circ Arrhythm Electrophysiol. 2015;8:633-42.
- Shimamoto K, et al. Heart. 2022;108:840-847.
- Priori SG, et al. Circulation. 2001;103:196-200.
- Mazzanti A, et al. JAMA Cardiol. 2022;7:504-512.
- van der Werf C, et al. Eur Heart J. 2019;40:2953-2961.
最終更新日:2023年07月24日
